文献解读 |Food Chemistry月度好文:撬动万亿蓝海市场的糖蛋白解析技术长什么样?


在“健康中国2030”战略推动下,药食同源领域正经历从经验传承向科学实证的跨越式发展。
据有关调研数据显示,2024年全球功能性食品市场规模将达到1万亿元,预计2030年将突破1.4万亿元!
在众多功能活性物质中,糖基化蛋白因其独特的“结构-功能”特性备受瞩目:这类通过糖链精确调控的蛋白分子,不仅是燕窝、阿胶等传统滋补品的核心功效成分,更在免疫调节、神经保护、抗肿瘤等现代健康领域展现巨大潜力。
在功能性食品经济快速发展的今天,糖基化蛋白糖链结构的“分子密码”,正成为解码食药同源物质科学内涵的关键突破口。

糖蛋白参与生物体内多种功能活性,是食用燕窝(EBN)中最主要的功能成分之一。
2025年3月发表在Food Chemistry上的题为“Comprehensive site- and structure-specific profiling of N-glycosylation of edible bird's nest (EBN) proteome using label-free quantitative glycoproteomics”文章中,作者通过糖蛋白组研究,鉴定出127种糖蛋白,这些结果和数据分析内容,为EBN糖蛋白位点特异性N-糖基化及其生物学作用和过程提供了见解。

研究对象:燕窝
技术方法:N-糖修饰蛋白组
研究思路:

作为功能性食品领域的研究热点,糖基化蛋白还可以拓展出以下课题:
传统滋补品现代化:如阿胶中糖胺聚糖-胶原蛋白复合物的构效关系研究,可建立胶类产品质量评价新标准。
植物活性物开发:枸杞多糖-蛋白复合物的糖基化修饰研究,或可揭示其免疫调节的分子机制。
海洋生物资源利用:海参体壁糖蛋白的唾液酸化修饰分析,可能打开抗凝血药物开发新路径。
上述研究方向结合了重要科学价值发掘和建立原料溯源、工艺优化、功效评价的完整产业链推动。
建议在文章投稿时重点关注技术创新与产业转化的衔接性研究。
1.EBN 糖蛋白的全面分析和鉴定
作者用无标记糖蛋白组学方法鉴定了EBN中的N-糖基化蛋白,如图1,共检测出9556个完整的 N-糖肽,映射到127个糖蛋白的486个糖基上,其中,house-EBN中识别出 237 个 N-糖组成,cave-EBN 中识别出 275 个 N-糖组成,在house-EBN和cave-EBN之间,有8种糖蛋白、288个完整的N-糖肽和235个N-聚糖被鉴定为两者共有。
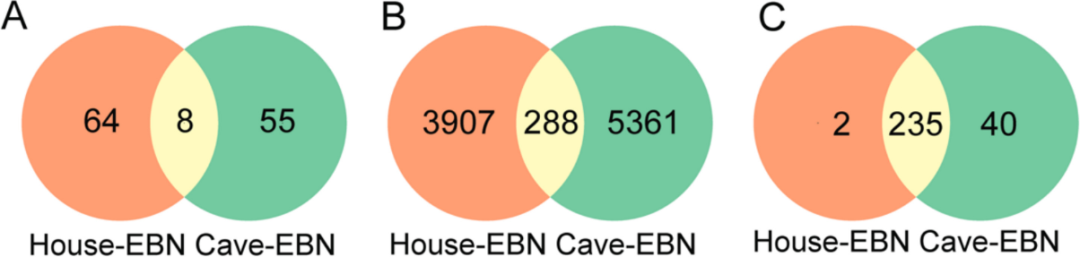
图1 两种燕窝的糖蛋白数量分析
无标记定量技术,通过高分辨质谱直接检测酶解糖肽的离子强度差异,突破了传统标记法通量限制——如图1展示的9556个N-糖肽鉴定数据。
这种技术适用于以下场景:
天然产物复杂糖型的全景解析。
加工过程中糖链结构动态变化的追踪。
功效成分批次一致性的质控分析。
无标记定量技术的高灵敏度,为功能性食品开发提供了精准“分子尺”,大幅度推进了研究进展。
| 三黍服务 | 技术参数 |
N-糖基化蛋白质组学 完整糖肽分析 | |
N-糖基化蛋白质组学 位点鉴定分析 | |
O-糖基化蛋白质组学 完整糖肽分析 | |
更多检测项目,欢迎私信详询! | |
2.两种燕窝N-糖蛋白中的N-糖链分析
数据结果表明,作者获得了高质量的糖肽图谱(图2),为了进一步描述特征,作者选了两种EBN中相对丰度最高的10个N-聚糖进行了比较研究,共鉴定到了19种N-聚糖,其中9种为共表达。
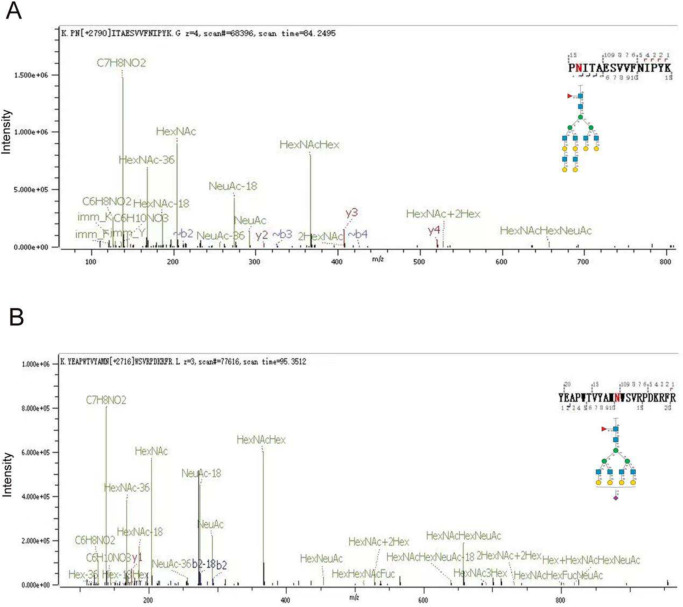
图2 完整 N-糖肽的 MS/MS 谱图示例
如图3所示,house-EBN中核心岩藻糖基化的HexNAc6Hex7FucNeuAc的占比最高(25.64%),而cave-EBN中有一个岩藻糖和三个唾液酸化修饰的HexNAc5Hex6FucNeuAc3最为显著(14.44%)。
在house-EBN和cave-EBN样本中,研究人员鉴定出了几种特定的N-糖,并根据其相对丰度排序。house-EBN中有4 种 N-糖,而cave-EBN中有5种N-糖,且这些N-糖都展示了岩藻糖基化或唾液酸化修饰,可能具有潜在的生物活性。这些 N-糖可能作为两种EBN的生物标志物
此外,末端唾液酸化的 N-糖在house-EBN和cave-EBN中占据最高的丰度,分别占到 90.61% 和 92.39%。唾液酸(特别是 Neu5Ac)在细胞相互作用、TNF 信号传导和抗氧化途径中起着重要作用,并且对于新生儿的中枢神经系统和免疫系统发育至关重要。核心岩藻糖基化的 N-糖在house-EBN和cave-EBN中也表现出较高的丰度,分别占到 78.95% 和 81.07%。核心岩藻糖基化是由岩藻糖基转移酶 8催化的,在肿瘤进程、免疫调节和干细胞分化中具有重要作用。
house-EBN中还首次检测到双分支 GlcNAc,该结构对细胞黏附等生物过程起到调控作用,并能够下调 EGFR/ERK 信号通路,从而抑制癌细胞的迁移和克隆形成,具有免疫生物学上的重要意义。

图3 House-EBN和cave-EBN糖蛋白中丰度最高的10种N-糖链的相对丰度
获得糖蛋白鉴定数据后,进一步聚焦N-糖链结构解析,体现了糖科学研究的核心逻辑——糖链细微差异可能引发功能剧变。
目前针对糖链的结构解析,我们可以采取的研究方法包括:
凝集素芯片:
快速高通量筛选特定糖链构型,可用于检测疾病状态下糖链结构变化,但糖链序列解析能力有限。
质谱技术:
利用酶解(如PNGase F)将糖链从蛋白质上释放,通过测量离子的质荷比(m/z)来确定糖链的分子量和结构信息(MALDI-TOF MS、HPLC-MS等),具有高灵敏度和高分辨率。
高效液相色谱:
通过色谱柱的分离作用,将糖链异构体分离开来,然后通过检测器(如紫外检测器、荧光检测器或质谱检测器)进行定量和定性分析。分为正相(分析极性糖链)和负相(分析疏水性糖链)等类别。
糖链酶解:
通过特定的糖苷酶(如PNGase F、Endo H等)对糖链进行部分或完全水解,然后通过质谱或色谱等方法分析酶解产物,推断糖链的结构和连接方式。能够提供糖链的连接方式和分支结构信息。
上述方法结合“糖蛋白鉴定→糖链解析→功能验证”三步策略,基本可以搭建较为完整的糖蛋白物质研究思路框架。
3.house-EBN和cave-EBN糖蛋白的宏观和微观异质性分析
结果显示,肽离子的质量差低于20 ppm(图4A),表明质谱数据精准。随后通过Weblogo 分析发现(图4B),house-EBN中的 N-X-T 序列(55.41%)略高于 N-X-S 序列(44.59%),而cave-EBN中 N-X-S 序列(76.99%)明显高于 N-X-T 序列(23.01%)(图4C-D)。
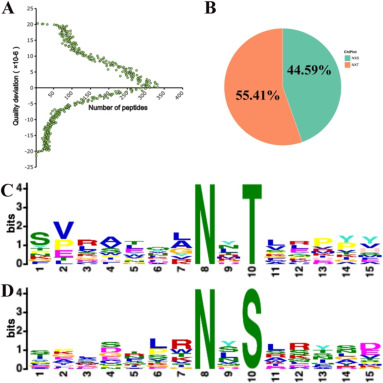
图4 N-糖基化肽的特性
宏观异质性方面,house-EBN中单N-糖基化位点的糖蛋白数量高于cave-EBN,而cave-EBN中含多个 N-糖基化位点的糖蛋白数量高于house-EBN(图5)。此外,研究中还分析了高度糖基化的蛋白,作者发现 N-糖基化有助于蛋白质在信号识别、细胞间相互作用和受体-配体相互作用中的功能。
在微观异质性方面,同一糖蛋白的不同糖基化位点上可能具有不同的 N-糖。house-EBN和cave-EBN中的 A0A093BGF3 蛋白在相同的 N-糖位点上存在不同的N-糖。house-EBN中有 126 种不同的 N-糖,而cave-EBN中有 195 种,且两者在不同 N-糖的比例上有所不同。house-EBN和cave-EBN中的唾液酸化和岩藻糖化糖型分别占有不同的比例,展示了EBN N-糖蛋白的高度微观异质性。

图5 cave-EBN(A)和house-EBN(B)中每个公认的N-糖蛋白的N-糖基化位点的数量
4.house-EBN和cave-EBN中共鉴定的N-糖蛋白分析
通过比较分析,作者鉴定到了house-EBN和cave-EBN之间共享的8种N-糖蛋白,结果显示,只有 高尔基体蛋白1在二者之间存在显著差异,该蛋白在house-EBN中只有一个糖基化位点(N-19),而在cave-EBN中有 3 个糖基化位点(N-19、N-64、N-642),且其 N-糖种类更多。此外,两种EBN在共享蛋白的糖基化位点数量上也存在差异。总体而言,cave-EBN中N-糖基化的修饰比house-EBN更多,影响因素可能有营养摄入、气候条件和生理压力等,不同的生活环境和饮食结构都可能与糖基化的变化有关。
5.house-EBN和cave-EBN中N-糖蛋白的GO分析
作者随后分析了在house-EBN和cave-EBN中鉴定出的N-糖基化蛋白的GO功能注释结果,共有491个生物过程被富集,其中166个具有统计学显著性。结果表明,BP中,house-EBN中的N-糖基化蛋白主要参与管道发育和细胞外基质的组织,cave-EBN中的N-糖基化蛋白主要涉及应激反应、免疫反应和白细胞激活。CC中,house-EBN主要在外泌体、细胞外囊泡和细胞外器官中,cave-EBN主要位于内膜系统、细胞质、膜结合囊泡和分泌颗粒。MF中,house-EBN主要与离子结合、酶结合和碳水化合物衍生物结合相关,cave-EBN主要与碳水化合物衍生物、受体和钙离子结合相关。
这些数据表明,N-糖基化发生在内质网-高尔基体分泌途径中,糖基被修剪和延伸,最终进入细胞膜和细胞外基质,且富含岩藻糖和唾液酸化的N-糖基是EBN中的特色。
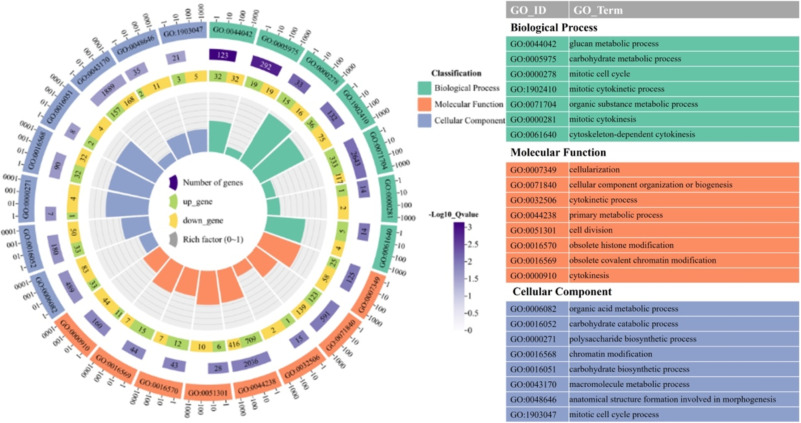
图6 house-EBN和cave-EBN中N-糖蛋白的GO分析
6.house-EBN和cave-EBN中N-糖蛋白的KEGG分析
作者进一步分析了N-糖基化蛋白的KEGG通路(图7),结果显示,house-EBN中的糖蛋白主要参与信号转导、运输、代谢、细胞运动、免疫系统、消化系统、发育和再生衰老,Hippo信号通路、PI3K-Akt信号通路和癌症相关通路,而cave-EBN主要富集于脂质代谢、信号转导、信号分子与相互作用、细胞群体-真核生物、细胞运动、免疫系统和循环系统,肌动蛋白细胞骨架调控、TNF信号通路、肾上腺素信号通路和ECM-受体相互作用。
这些数据表明,EBN中的N-糖基化蛋白可能通过调控这些代谢通路发挥积极的生物学效应,但N-糖基化模式在人体MFGM蛋白底物中的作用仍需进一步研究。
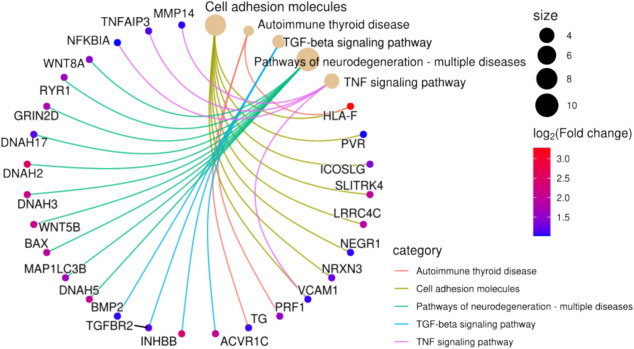
图7 house-EBN和cave-EBN中N-糖蛋白的KEGG分析
GO/KEGG分析将分子特征与生物学功能链接,从系统生物学的角度理解糖蛋白的功能、代谢途径以及它们在细胞过程中的作用,可延伸应用于:
功能预测:根据结构对糖链进行分组富集分析,通过通路富集推测未知糖蛋白活性,明确产品功效。
产品定位:根据通路特征划分免疫增强/抗衰老等品类,提高产品定位差异性。
工艺优化:时间序列样本,追踪关键通路蛋白在加工中的稳定性,指导生产工艺优化。
在这项研究中,作者通过非标记的糖蛋白组检测,鉴定了两种燕窝的N-糖基化蛋白,研究发现,cave-EBN中鉴定的糖蛋白数量低于house-EBN,但其独特糖基的数量更高。GO注释揭示了位点特异性N-糖基化的功能,house-EBN中的N-糖基化蛋白富集在Hippo信号通路、PI3K-Akt信号通路和癌症相关通路中,而cave-EBN中的N-糖基化蛋白则主要富集于TNF信号通路和ECM-受体相互作用等方面。该研究首次全面考察了EBN环境中N-糖基化特征,并为比较分析house-EBN与cave-EBN提供了科学依据,揭示了N-糖基化蛋白和N-糖基组成之间的关系,为燕窝在功能性食品中的应用提供了理论支持。

本研究构建了"糖基化全景解析—功能通路映射—活性机制推测"的完整框架。按照这个思路,我们可以拓展到国家自然科学基金、省部级课题等食药同源糖蛋白成分研究课题设计申报:
总结一下可以尝试的几类选题框架——
目标物质筛选与糖型特征解析:
特定食药同源物质中是否存在特征性糖基化修饰?其结构多样性如何?
通过糖蛋白组学技术获取糖蛋白定性定量数据和糖链分析,解析目标物质的完整糖型谱。结合转录组测序等技术,挖掘糖基转移酶表达情况。整合数据构建糖型-酶表达关联网络,完善对特定物质糖蛋白糖基化修饰的认知。
糖基化功能机制的多维度解析:
特征性糖链如何调控生物学功能?其分子作用靶点是什么?
在掌握样本中糖蛋白分布情况基础上,通过解析糖蛋白-受体复合物的三维结构(冷冻电镜)、探测糖链修饰对蛋白构象动态的影响、构建糖基转移酶敲除细胞系验证糖链调控作用、设计转基因动物模型跟踪糖蛋白调控变化等环节,阐明糖链功能调控的完整通路。
糖基化调控网络的系统生物学研究:
环境因素如何影响糖基化修饰?其表观遗传调控机制是什么?
通过设计环境响应研究(环境胁迫实验+甲基化测序),探究不同条件和时间阶段糖蛋白组的糖型变化和糖基转移酶调控机制。此外,还可以通过单细胞多组学技术,了解组织异质性对糖基化的影响。

糖基化蛋白组研究正在重塑食药同源认知维度,这一研究方向的潜能尚未被完全发掘。无论您是科研工作者,或是企业研发团队,如果对:
传统滋补品功效物质基础研究
功能性食品活性成分筛选
食品加工过程成分追踪
……
这类研究方向感兴趣,欢迎与我们联系!
三黍生物拥有十年多糖研究经验,世界领先蛋白组解析技术,为您提供包括高精度糖蛋白组检测-多维功能注释-多组学验证-多糖结构解析等全套解决方案。
欢迎联系您的客户经理,或私信联系我们,获取专属研究方案,共同解锁糖蛋白的产业密码!
滑动查看更多:
排版:野凌
审核:三黍生物企宣部




