基金委2025重大研究方向,串联铁死亡等热点,普通科研人竟然也能做!


2025年,国家自然科学基金委员会发布《破译生命的糖质密码重大研究计划》,将糖质(glycan)研究提升至国家战略高度。糖质作为生命信息的重要载体,与疾病发生、免疫调控、生殖健康等密切相关,但其复杂结构与功能映射关系仍是后基因组时代的科学前沿。
该计划提出三大核心科学问题:开发糖质解码工具、解析功能编码规律和发展疾病干预策略,并重点支持糖质标志物发现、原位编辑技术、AI解析等方向。
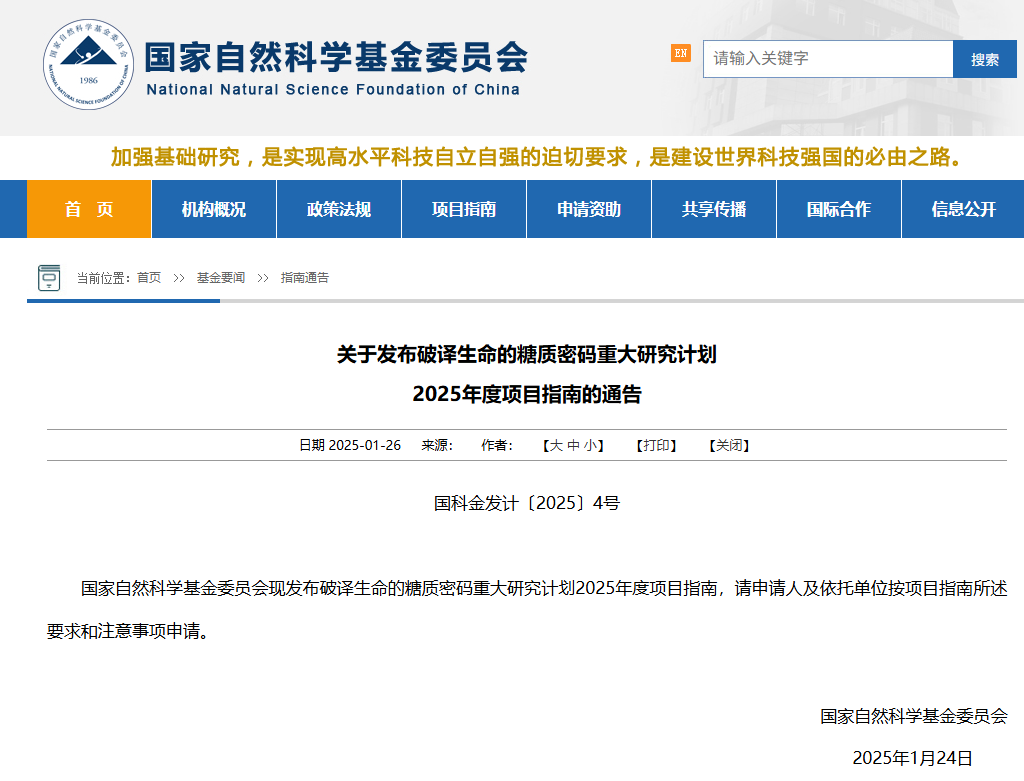
如今,糖基化研究已从单一分子分析迈向多组学整合与精准调控时代,为疾病诊疗、药物开发提供全新视角。
作为一个大有潜力的研究热点,我们应当如何设计、开展一个糖蛋白研究课题?

卵巢衰老通常先于其他器官衰退类型,但其分子机制尚不明确。
2025年4月发表在Redox Biology上的题为“A high-resolution N-glycoproteome landscape of aging mouse ovary”的文章中,作者通过蛋白组和N-糖基化修饰蛋白组,首次报道了糖基化在该过程中的独特作用,并发现老年鼠卵巢中的糖基化蛋白种类和数量均降低,修饰类型也发生改变等,这些结构改变可能导致了卵巢微环境的改变,并影响了卵巢老化过程,这为卵巢功能保护与延缓衰老提供了潜在的干预靶点。

研究对象:小鼠(n=15)
技术方法:蛋白组,糖基化蛋白组,磷酸化蛋白组
研究思路:
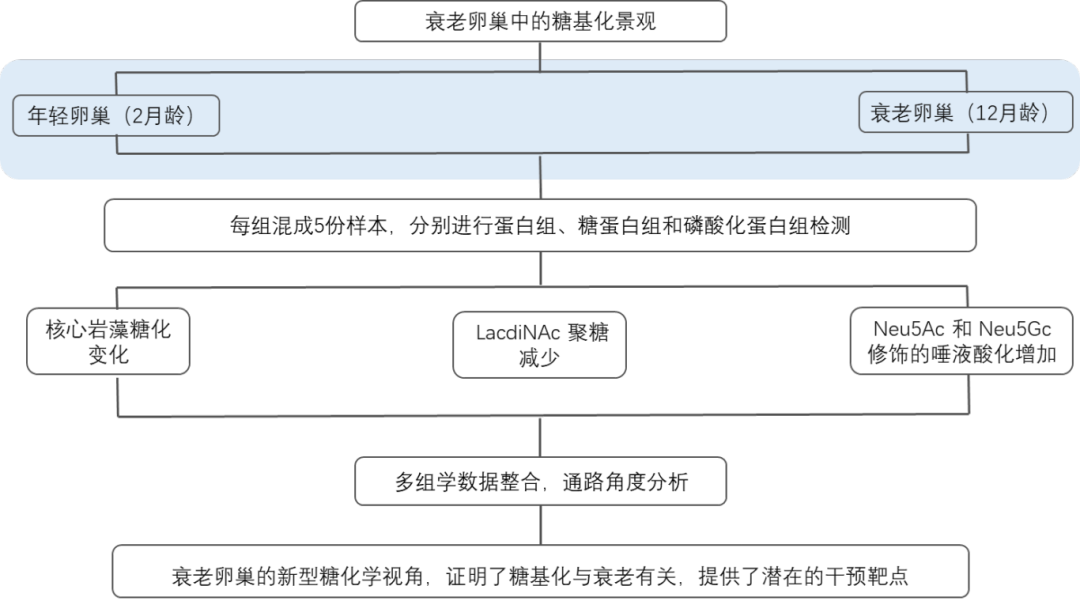
糖基化修饰的复杂性为医学研究提供了多维切入点,结合文献与基金指南,以下选题方向可以参考:
肿瘤免疫调控:解析肿瘤微环境中糖质修饰如何影响免疫细胞识别与耐受(如PD-L1糖基化修饰与免疫逃逸)。
生殖健康与衰老:卵巢透明带糖链结构与生育力关联(如LacdiNAc糖链减少导致卵母细胞质量下降)。
神经退行性疾病:糖基化异常与阿尔茨海默症中β-淀粉样蛋白聚集的关系(如唾液酸化修饰调控炎症通路)。
代谢性疾病:AGEs(晚期糖基化终末产物)在糖尿病并发症中的作用及饮食干预策略。
1.衰老小鼠卵巢的蛋白组分析
作者首先收集了2月龄年轻小鼠和12月龄中年小鼠的卵巢组织各15份,分别代表20岁和45岁左右的人类女性。组织学结果显示,中年卵巢中的不同发育阶段卵泡减少,伴随闭锁卵泡显著增多,且出现明显的纤维化(图1A-B)。随后将每组样本合并混合为5份,进行糖蛋白组、磷酸化蛋白组和整体蛋白组的分析,最终鉴定出9033种蛋白和2270种N-糖蛋白及2590种磷酸化蛋白(图1C-D)。
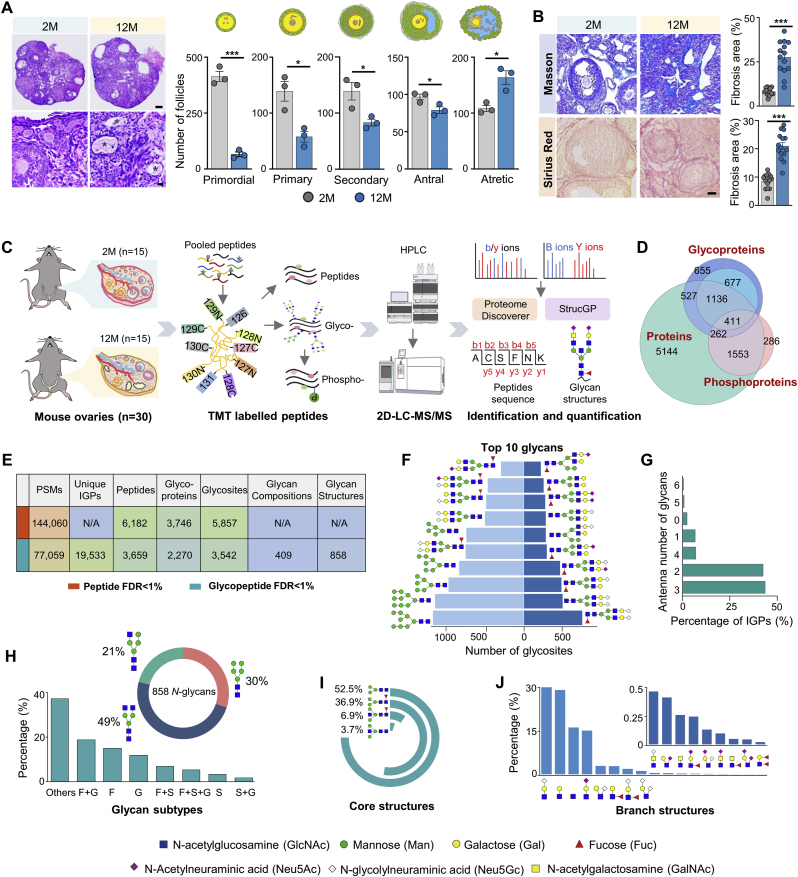
图1 衰老小鼠卵巢的糖蛋白组学、蛋白质组学和磷酸化蛋白质组学分析
在做糖蛋白方向课题时,根据所研究的疾病类型,我们在采集样本时也可以采取不同的策略。
肿瘤方向:对比癌组织与癌旁组织的糖蛋白组,筛选免疫检查点糖基化标志物。
神经疾病:分析脑脊液外泌体糖蛋白,挖掘帕金森病早期诊断标志物。
代谢疾病:研究糖尿病患者血清糖蛋白动态变化,关联血糖调控机制。
其他样本建议:临床组织(如肿瘤活检)、体液(血液、脑脊液)、细胞模型(类器官/原代细胞)。
2.小鼠卵巢的糖蛋白景观
作者鉴定到了3746个N-糖蛋白中的5857个N-糖基化位点,在糖链水平过滤后,得到了858种N-糖链,3542个糖基位点和2270个N-糖蛋白(图1E)。结果显示,近一半的糖链有多个结构异构体,且蛋白上修饰最多的糖链为唾液酸化的双分支结构和寡甘露糖型(图1F-G)。此外,尽管卵巢中主要糖链以双分支和三分支为主,也检测到了5-6分支的高分支糖链,通常携带唾液酸或岩藻糖,这在年龄增长中显著下降,且与生育调控密切相关。
在N-糖结构中,大多数糖基位点为复合聚糖,糖链中主要为唾液酸化、岩藻糖化或二者的聚糖修饰,核心结构以N2H3和岩藻糖化为主,分支结构以LacNAc和LacdiNAc终止结构为主(图1H-I)。
N-糖基化位点:
N-糖基化位点是指蛋白质序列中特定的天冬酰胺(Asn-X-Ser/Thr)残基,其糖链修饰可影响蛋白折叠、稳定性、亚细胞定位及分子互作(如受体-配体识别)。其鉴定技术主要通过质谱联用酶切法(如PNGase F酶切释放糖链)结合数据库匹配(如UniProt糖基化位点注释),实现高精度位点定位。
糖链异构体:
糖链异构体指同一糖基化位点上糖链分支结构或修饰的差异,其生物学意义重大,如:
双分支唾液酸化糖链(如Siaα2-6Galβ1-4GlcNAc)参与免疫调节,双/三分支结构(复合型)多见于成熟分泌蛋白,参与细胞黏附;
高分支结构(5-6分支)可能通过空间位阻调控信号通路,与病原体逃逸或肿瘤转移相关;
寡甘露糖型(Man5-9GlcNAc2)常见于未成熟糖蛋白,提示内质网加工状态。
糖链的聚糖修饰:
糖链的聚糖修饰(如唾液酸化、岩藻糖化)可赋予蛋白新功能。核心结构决定糖链加工方向,分支结构影响分子识别,终止结构(如硫酸化、唾液酸化)则决定最终生物活性。
| 三黍服务 | 技术参数 |
N-糖基化蛋白质组学 完整糖肽分析 | |
N-糖基化蛋白质组学 位点鉴定分析 | |
O-糖基化蛋白质组学 完整糖肽分析 |
3.不同的亚细胞定位表现出多样化的糖链结构模式
根据UniprotKB数据库的亚细胞定位注释,糖蛋白主要集中在内质网、细胞骨架、高尔基体和溶酶体。卵膜区的糖蛋白呈现更高比例的复合糖链和核心岩藻糖化,分支结构多样,但唾液酸修饰少,与其他亚细胞区域区别明显。在功能分析中,与卵膜结构组成相关的糖蛋白所携带的糖链同样以复合糖链和岩藻糖化结构为主,在与生殖过程相关的糖蛋白中,LacdiNAc分支含量显著升高,提示了该结构的重要性(图2)。
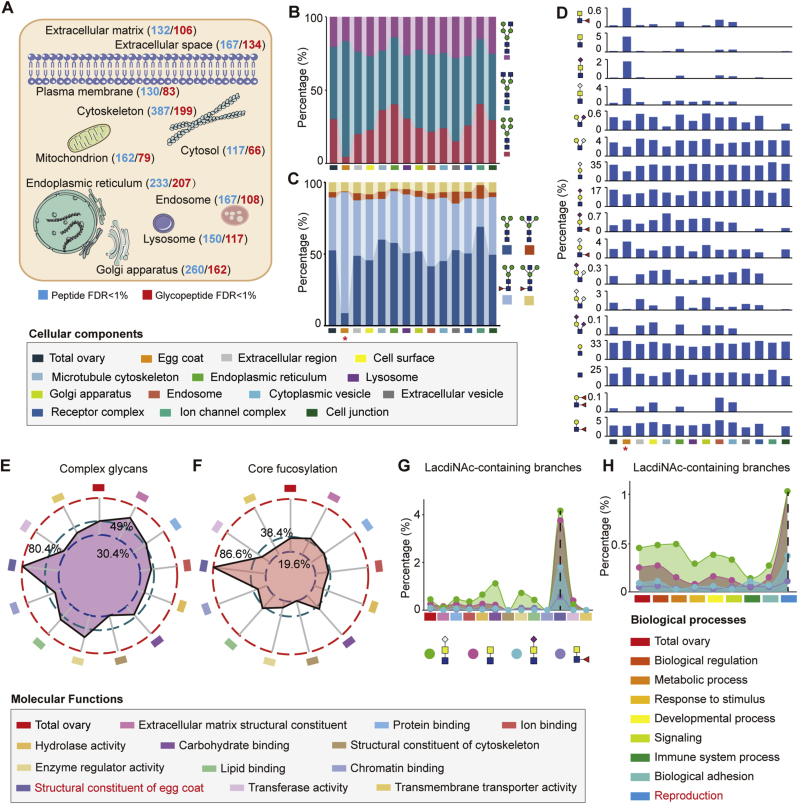
图2 小鼠卵巢中糖蛋白不同亚细胞定位的聚糖结构模式
糖基化修饰具有空间特异性,不同细胞器(如内质网、高尔基体、细胞膜)的糖链加工酶分布差异,导致糖蛋白功能分化。例如,内质网中的寡甘露糖型糖蛋白可能参与蛋白折叠质量控制,而细胞膜上的复合型糖链直接介导细胞间通讯。
在医学方向课题中,我们可通过以下步骤设计糖基化蛋白在亚细胞层面功能的验证:
定位注释:
利用UniprotKB等数据库获取糖蛋白亚细胞分布(如分泌途径、溶酶体),结合免疫荧光/电镜验证。
功能关联:
基因敲除/过表达糖基转移酶,观察亚细胞定位变化及表型。
互作验证:
采用凝集素pull-down筛选结合受体,揭示糖链-功能轴。
4.Gly对肝胰腺蛋白表达的影响
在定量分析中,中年卵巢中有1556个上调糖肽,而下调糖肽有293个,其中,83%的差异糖肽来源于整体蛋白水平无显著变化的糖蛋白,这表明与衰老相关的糖肽变化不是基于蛋白表达,而是位点特异性糖基化修饰导致的(图3A-F)。在随后的功能分析中显示,聚糖上调的糖蛋白主要参与ROS生物合成,胶原蛋白代谢和免疫过程,下调的糖蛋白主要参与ROS代谢,胚胎发育,精卵识别和生殖过程(图3G)。进一步的聚糖结构分析结果表明,胶原代谢偏好Lewisx/a 结构,生殖过程富含复杂聚糖和LacdiNAc分支结构,ROS更偏向展现不同核心/分支结构变化(图3H-K)。
这些结果表明,糖基化不仅是被动标记,还可能主动调控特定通路和生理功能。
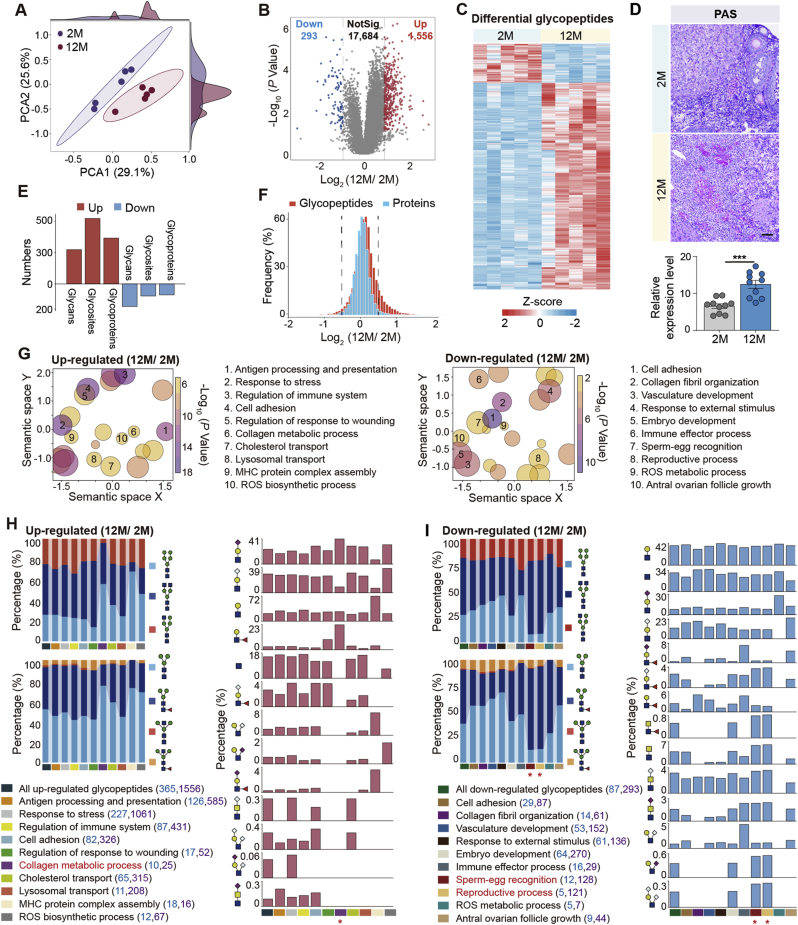
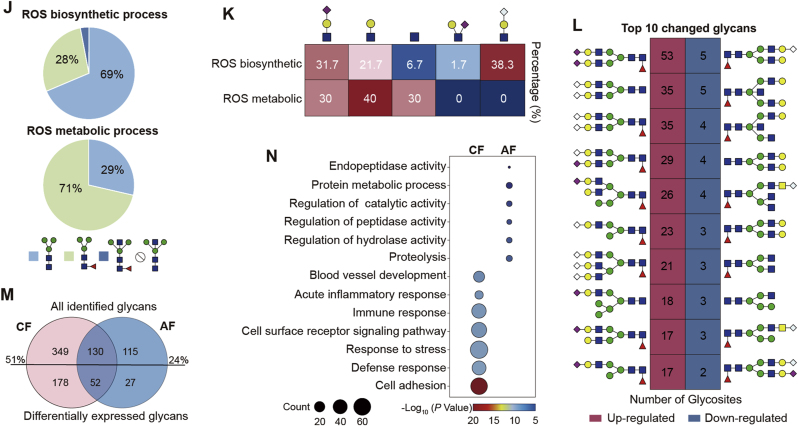
图3 卵巢衰老过程中的位点特异性糖基化改变
在验证蛋白糖基化修饰的功能时,我们可以从以下几个角度入手——
表型关联:敲除特定糖基转移酶(如FUT8敲除岩藻糖化),观察目标蛋白表达变化及下游通路激活。
机制解析:通过糖链结构定点突变(CRISPR-Cas9基因编辑或利用糖基转移酶等),验证糖链修饰对蛋白活性(如酶促反应)的影响。
多组学整合:联合转录组/蛋白组,区分糖基化修饰与蛋白表达水平的独立调控。
如果需要进一步探究蛋白的聚糖结构,可以参考以下策略——
质谱解析:采用MALDI-TOF或LC-MS/MS鉴定糖链组成(如LacdiNAc分支)。
凝集素芯片:利用凝集素定量糖链丰度。
功能聚类:根据糖链结构(如Lewisx/a)将差异糖肽映射至特定通路。
| 三黍服务 | 技术参数 |
Astral DIA 血液低丰度蛋白组分析 | |
极微量蛋白组分析 | |
PRM蛋白相对含量分析 | |
真核转录组测序 | |
ChIP-Seq(动物,转录因子/组蛋白修饰) | |
更多服务,欢迎私信详询! | |
5.核心岩藻糖在卵巢衰老中成高频率变化
衰老卵巢上下调前10位的聚糖中,岩藻糖基化呈现了高频变化,而唾液酸主要呈增加趋势。其中,不同类型的岩藻糖对应不同的生物学功能,核心岩藻糖化偏向免疫、黏附和应激反应,天线岩藻糖化则与酶活和代谢调节有关。这些数据表明,卵巢衰老是多通路,多位点调控的结果(图3L-N)。
上下调居前的聚糖类型(如核心岩藻糖化)通常指向关键调控节点。
高频上调:可能驱动病理进程。
机制解析:提示功能丧失。
分析各类聚糖的上/下调情况,有助于快速锁定疾病相关糖链(如卵巢衰老中的LacdiNAc),为靶向干预(如酶替代疗法)提供依据。
6.LacdiNAc糖链随透明带衰退而减少
作者统计了具有不同结构特征的糖链在衰老卵巢中的比例,发现排名前四的均为LacdiNAc相关分支结构,且在衰老卵巢中明显减少。免疫组化的结果显示,催化LacdiNAc合成的关键酶 B4GALNT3和B4GALNT4在衰老卵巢中的表达水平显著降低,使用Cy5标记的WFA凝聚素染色也证实了该现象(图4A-D)。
共识别到50个糖蛋白相关的176个LacdiNAc糖肽,主要位于细胞质,胞外区域,囊泡,高尔基体,内质网和透明带。从14种糖蛋白中鉴定到55种变化糖肽,其中8种在衰老卵巢中上调,47种下调(图E-G)。
在下调的LacdiNAc糖肽中,主要来自透明带的糖蛋白ZP2、ZP3和ASTL,与精卵结合,多精阻止以及透明带变性和生育能力下降等功能密切相关。上调的糖蛋白则与酶活性调节相关,多定位于高尔基体和胞外,功能与老化应答相关(图4H-K)。
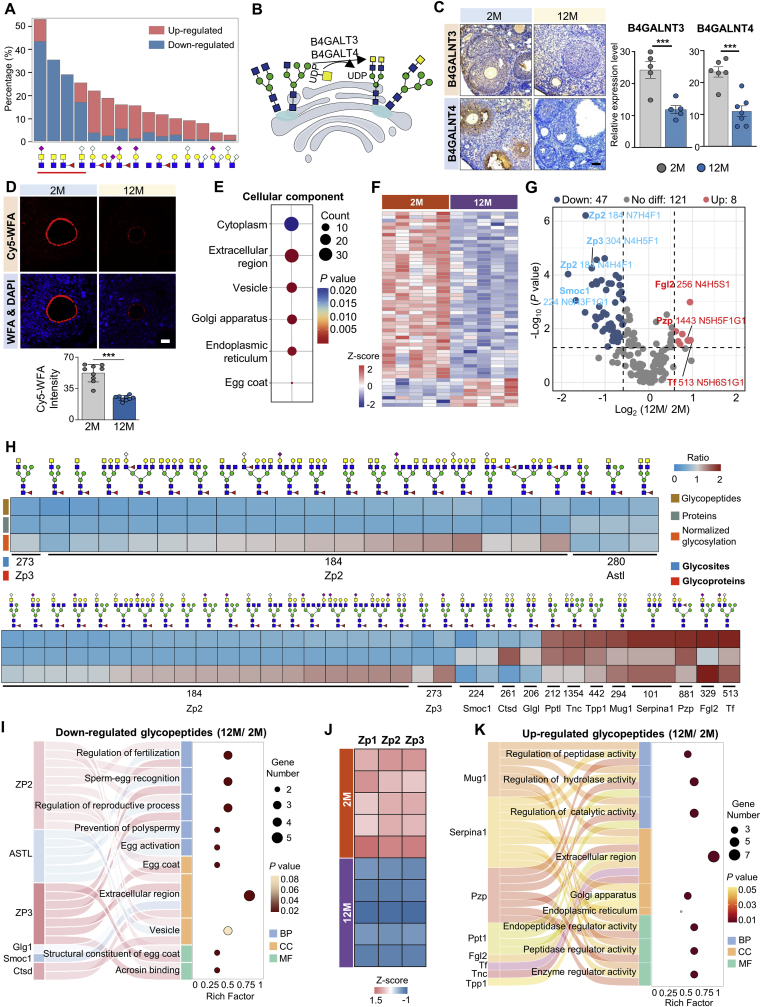
图4 LacdiNAc糖链随透明带衰退而减少
7.Neu5Ac和Neu5Gc在免疫调控中发挥不同作用
Neu5Ac和Neu5Gc是唾液酸的两种主要类型,仅有一个氧原子不同,结果中鉴定到了468种和86种仅被二者修饰的糖蛋白,且这些唾液酸糖肽大多数在衰老卵巢的糖基化水平上增加(图5A-D)。二者在免疫功能上也存在偏好性,Neu5Ac与整合素相关,如T细胞活化等,Neu5Gc与免疫球蛋白相关,参与补体激活,防御反应等(图5E)。
唾液酸的分支结构也会影响糖蛋白的功能。如Lewisx/a修饰中,Neu5Ac偏向免疫激活,Neu5Gc偏向酶调控;LacNAc中,Neu5Ac与应急响应强相关。天线唾液酸中,Neu5Gc与生殖过程起关键作用(图5F)。
这些结果表明,唾液酸的类型和分支结构都有可能影响其修饰的糖蛋白的免疫作用。
图5 Neu5Ac和Neu5Gc的增加在衰老卵巢中发挥不同的免疫调节作用
8.信号通路中涉及的糖基化变化
在进一步的分析中,作者整合了磷酸化和蛋白组的数据,对发生改变的糖肽/糖蛋白进行了通路分析。磷酸化分析中共识别到6022个位点,来自2554个磷酸化蛋白(图6A-C)。在衰老卵巢中,共有142个上调磷酸肽和36个蛋白,下调中有142个磷酸肽和73个蛋白(图6D-E)。多组学的通路整合分析中,共有62条共富集通路,主要包括补体和凝血级联反应、抗原处理与呈递、铁死亡和细胞凋亡。这些通路通常与卵巢功能下降和免疫微环境紊乱相关,是卵巢衰老的典型特征(图6F-G)。
亚细胞定位中,参与信号通路的相关糖蛋白集中在细胞表面,差异磷酸化蛋白集中在细胞质和细胞核。这表明糖基化改变可能位于磷酸化调控的上游位置。
PPI分析结果表明,前10个关键信号节点中有9个为糖蛋白。且不同类型的糖链涉及了不同的信号通路,其中,补体、凝血通路富含唾液酸化LacdiNAc,antenna-Neu5Ac LacNAc和terminal-Neu5Gc Lewisx/a。抗原呈递中则主要为LacdiNAc,antenna-Neu5Ac LacNGc分支结构(图6H-M)。

图6 糖基化和磷酸化在信号通路中的不同作用
在通路分析中,铁死亡和细胞凋亡都因上调的糖肽而富集,且都在糖基化水平上升,而不是蛋白水平,并被不同的糖链结构修饰(图7A)。与铁死亡相关的糖肽以复合聚糖为特征,主要存在于细胞表面,参与细胞凋亡的糖肽则主要以寡甘露糖为特征,并位于溶酶体(图7B-C),细胞定位的不同可能是糖链结构差异的原因。铁死亡相关糖肽富集了唾液酸修饰,可能通过铁摄取激活死亡通路(图7D-E)。
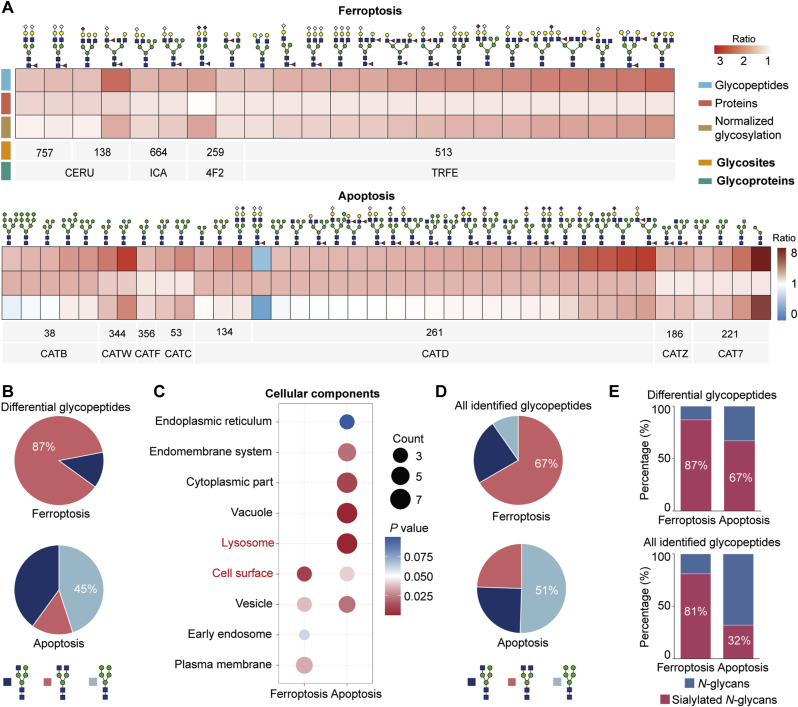
图7 与铁死亡和细胞凋亡相关的不同糖型
糖基化修饰与信号通路的关联研究揭示了其在疾病机制中的多维调控作用。
以铁死亡为例,这一由脂质过氧化驱动的程序性细胞死亡过程,其发生与胱氨酸/谷氨酸转运体功能抑制密切相关。唾液酸化修饰的糖蛋白在铁死亡通路上调,且这些糖链多定位于细胞表面,提示其可能通过调控膜蛋白的稳定性或受体互作影响铁离子摄取。
进一步的多组学整合策略(糖蛋白组+磷酸化组)可揭示修饰级联效应:糖基化通过改变蛋白构象(如遮蔽磷酸化位点等)间接调控下游信号。
研究思路总结:
通过“糖链结构解析→亚细胞定位→通路富集→功能实验”的链条,可将糖基化修饰精准关联至特定医学热点,为疾病机制解析及干预策略设计提供创新思路。
| 三黍服务 | 技术参数 |
Astral DIA 磷酸化修饰蛋白组分析 | |
4D-DIA 泛素化修饰蛋白组分析 | |
4D-DIA 乙酰化修饰蛋白组分析 | |
非靶代谢组学 | |
非靶脂质组学 | |
更多服务,欢迎私信详询! | |
在本项研究中,作者通过蛋白组、N-糖基化蛋白组和磷酸化蛋白组,辅以免疫组化等分子实验,首次分析了衰老过程中的卵巢糖基化景观,主要汇总了与细胞粘附和免疫反应相关的核心岩藻糖基化频繁变化,导致生育能力下降的透明带上的 LacdiNAc 聚糖减少,以及由 Neu5Ac 和 Neu5Gc 修饰的唾液酸化聚糖增加在免疫激活和反应中发挥不同的作用,还进一步分析了糖基化在关键通路中的作用。该研究为衰老卵巢提供了糖生物学的新观点,为卵巢功能保护与延缓衰老提供了潜在的干预靶点。

糖基化可串联铁死亡、免疫治疗、衰老等多个科研热点,并从“结构解析”到“动态修饰网络”,全方位揭示翻译后修饰的时空调控规律。结合AI驱动的糖链预测模型和原位编辑技术,可更有效地推动精准医学研究的发展。
总结一下结合糖蛋白热点的研究主要框架——
科学问题:聚焦疾病特异性糖链(如肿瘤相关抗原)。
技术路线:糖蛋白组+功能验证(凝集素阻断/酶活性检测)。
临床转化:开发糖质标志物检测试剂盒或糖优化药物。
如果您对糖基化蛋白研究感兴趣,欢迎体验三黍生物“课题设计-样本检测-数据解析”的全流程解决方案,携手手国内领先的糖组学专家团队,共同抢占“糖质密码”研究先机!
滑动查看更多:
排版:野凌
审核:三黍生物企宣部




