

服务简介
基因克隆技术可概括为∶分、切、连、转、选。最终目的在于通过相应技术手段,将目的基因导入寄主细胞,在宿主细胞内目的基因被大量的复制。一般来说,基因克隆技术包括把来自不同生物的基因同有自主复制能力的载体DNA在体外人工连接,构建成新的重组DNA,然后送入受体生物中去表达,从而产生遗传物质和状态的转移和重新组合。因此基因克隆技术又称为分子克隆、基因的无性繁殖、基因操作、重组DNA技术以及基因工程等。
载体是整个基因工程的基石,是DNA重组技术的核心要素。为了满足研究的需要,我们需要按照自己的意愿有目的的去构建和改造载体,最终实现扩增目标片段或者特定蛋白表达等目的。虽然载体构建是分子生物学研究中最常用的技术之一,但由于构建目的的多样性,加之实际操作中影响因素较多,对研究者经验要求较高,因而往往费时费力。
我公司提供专业优质的过表达载体、RNAi载体、CRISPR/Cas9敲除载体构建技术服务,目标对象包括动物(人源细胞、鼠源细胞等)、植物(甘薯、木薯、马铃薯、杨树等)、微生物(大肠杆菌、放线菌、梭菌等)。公司拥有专业的仪器设备和技术人员支持,周期短,效果好,质量优,价格低。
技术路线


方案设计

目的基因克隆


构建


测序验证


报告出具
技术优势
高效,构建周期短,可快速交付;
稳定优质,经验丰富的分子生物学专家将完全贴合您的需求进行方案设计;
服务周到,提供售前咨询、售后技术支持;
样本要求
1、实验材料与相关资料
普通载体构建改造:载体、PCR或者酶切产物、载体图谱、载体来源信息与基因背景资料;
表达载体、报告基因载体、病毒载体:载体、含目的基因的质粒或cDNA模板、载体图谱与序列信息、目标蛋白基因序列与酶切位点信息。
请确认待改造的载体序列正确,与提供的图谱等信息匹配,构建完成后如需测序并且要求序列完全匹配,则需要您提供全序列信息;
如果您只提供组织或细胞样本,请提供所需克隆基因的NCBI登录号或电子版全序列,本公司将额外收取RNA提取及逆转录的费用;
对于本公司已有的载体和模板,我们可以免费提供;
由于生物实验的不确定性,对于结果为阴性的项目,公司将正常收取部分物料费用。
2、RNAi干扰载体构建
RNA干扰(RNA interference, RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。
我公司提供专业优质的RNAi载体构建技术服务,目标对象包括动物(人源细胞、鼠源细胞等)、植物(拟南芥、水稻、小麦、玉米等)、微生物(大肠杆菌、放线菌、梭菌等)。公司拥有专业的仪器设备和技术人员支持,周期短,效果好,质量优,价格低。
服务内容
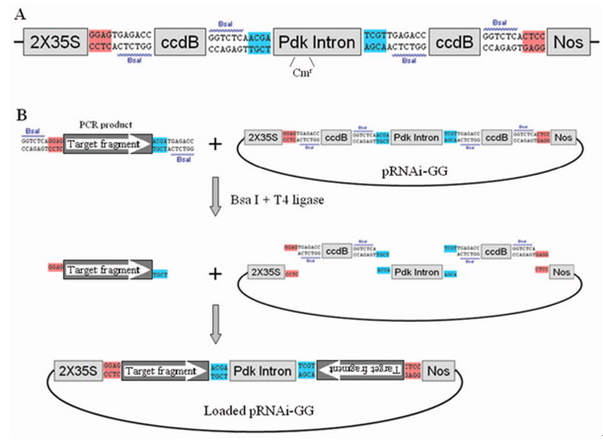
服务说明
• 客户需提供载体、含目的基因的质粒或cDNA模板、载体图谱与序列信息、目标蛋白基因序列与酶切位点信息。
• 请确认待实验的载体、目的基因片段序列正确,与提供的图谱等信息匹配,构建完成后如需测序并且要求序列完全匹配,则需要您提供全序列信息;
• 如果您只提供组织或细胞样本,请提供所需克隆基因的NCBI登录号或电子版全序列,并额外收取RNA提取及逆转录的费用;
• RNA干扰载体的构建分为两个部分,第一部分主要是在中间载体上构建RNAi的发卡结构,第二部分主要是把中间载体上的发卡结构转移到表达载体上。
3、PET表达载体构建
PET系统是有史以来在 E.coli中克隆表达重组蛋白的功能最强大的系统。目的基因被克隆到 PET质粒载体上,受噬菌体 T7强转录及翻译(可选择)信号控制;表达由宿主细胞提供的T7 RNA聚合酶诱导。T7 RNA 聚合酶机制十分有效并具选择性:充分诱导时,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几个小时,目的蛋白通常可以占到细胞总蛋白的50%以上。
我公司提供专业优质的PET表达载体构建技术服务,目标对象包括动物(人源细胞、鼠源细胞等)、植物(拟南芥、水稻、小麦、玉米等)、微生物(大肠杆菌、放线菌、梭菌等)。公司拥有专业的仪器设备和技术人员支持,周期短,效果好,质量优,价格低。
服务内容
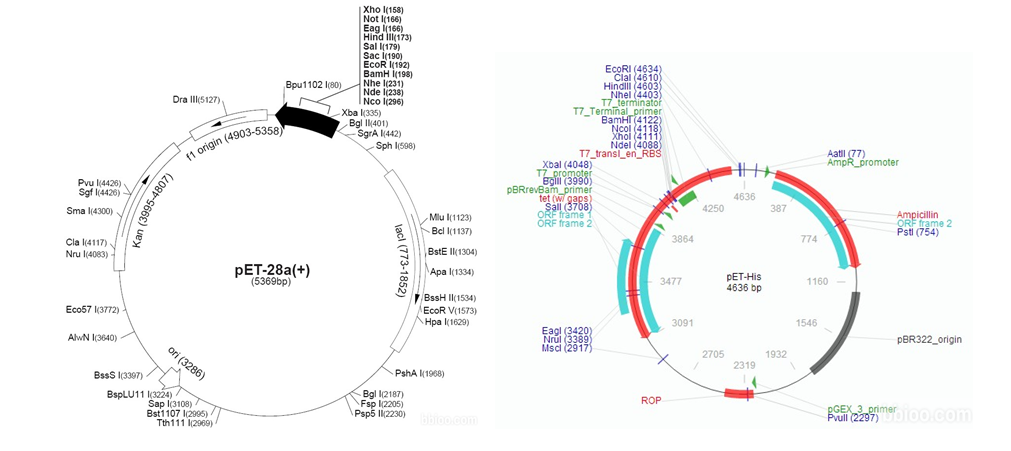
服务说明
• 客户需提供载体、含目的基因的质粒或cDNA模板、载体图谱与序列信息、目标蛋白基因序列与酶切位点信息。
•请确认待实验的载体、目的基因片段序列正确,与提供的图谱等信息匹配,构建完成后如需测序并且要求序列完全匹配,则需要您提供全序列信息;
• 如果您只提供组织或细胞样本,请提供所需克隆基因的NCBI登录号或电子版全序列,并额外收取RNA提取及逆转录的费用;
• 对于本公司已有的载体和模板,我们可以免费提供。
4、Gateway表达载体构建
Gateway技术是基于lambda噬菌体的位点特异性重组反应,在目的片段两端添加重组位点,将PCR产物与含重组位点的目的载体混合重组反应便可直接转化筛选重组克隆,与经典克隆多个步骤相比,该方法只需一步生化反应便能达到目的,是高通量克隆基因的好方法。Gateway技术提供以下可能: 通过去除冗长的亚克隆步骤节省您的时间,同时将您的基因转移到多个表达系统 在任何您选择的系统――体外,细菌,酵母,昆虫,或哺乳动物――分析表达。
我公司提供专业优质的Gateway载体构建技术服务,目标对象包括动物(人源细胞、鼠源细胞等)、植物(拟南芥、水稻、小麦、玉米等)、微生物(大肠杆菌、放线菌、梭菌等)。公司拥有专业的仪器设备和技术人员支持,周期短,效果好,质量优,价格低。
服务内容
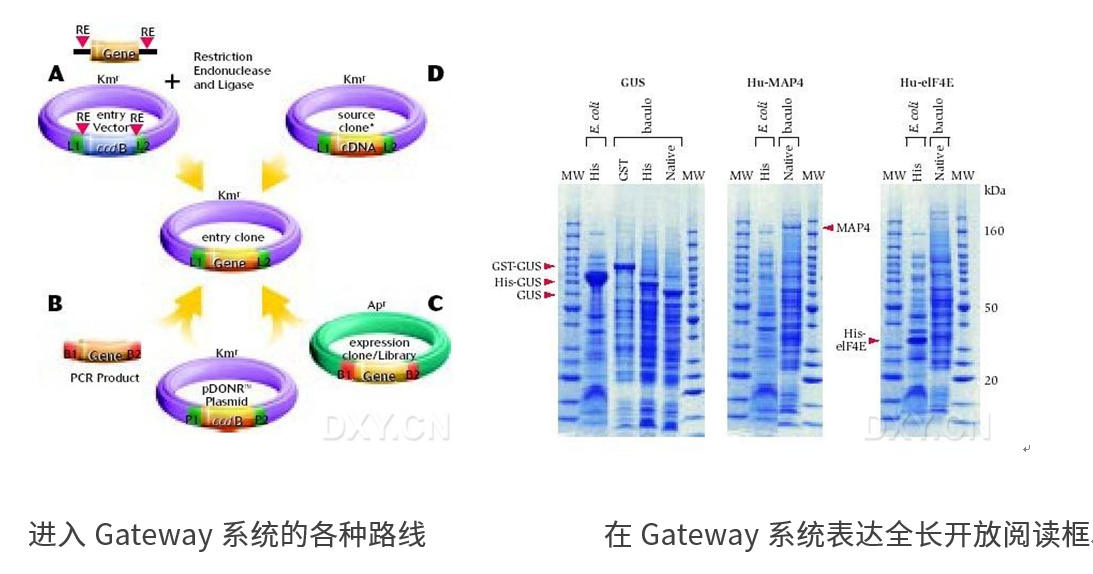
服务说明
• 客户需提供载体、含目的基因的质粒或cDNA模板、载体图谱与序列信息、目标蛋白基因序列与酶切位点信息。
• 请确认待实验的载体、目的基因片段序列正确,与提供的图谱等信息匹配,构建完成后如需测序并且要求序列完全匹配,则需要您提供全序列信息;
• 如果您只提供组织或细胞样本,请提供所需克隆基因的NCBI登录号或电子版全序列,并额外收取RNA提取及逆转录的费用;
• 对于本公司已有的载体和模板,我们可以免费提供。
5、Crispr/cas9载体构建
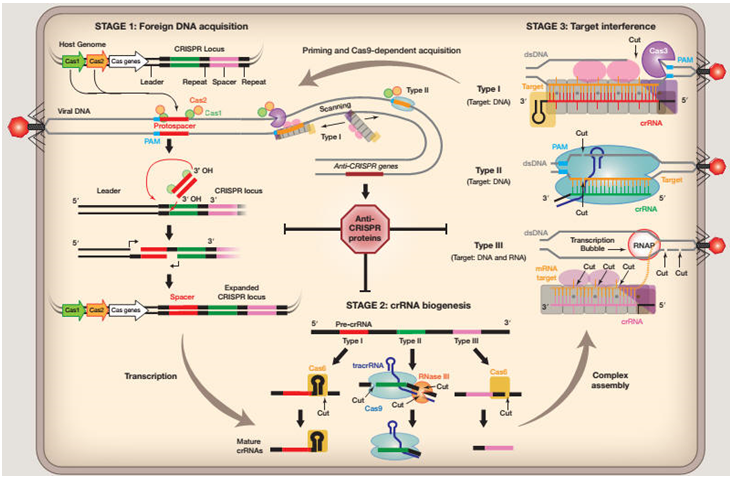
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) /Cas (CRISPR-associated) 是最近几年出现的一种由RNA指导Cas核酸酶对靶向基因进行特定DNA修饰的技术。它是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。
此系统的工作原理是crRNA (CRISPR-derived RNA) 通过碱基配对与 tracrRNA (trans-activating RNA) 结合形成 tracrRNA/crRNA 复合物,此复合物引导核酸酶 Cas9 蛋白在与 crRNA 配对的序列靶位点处剪切双链 DNA,从而实现对基因组DNA序列进行编辑;而通过人工设计这两种 RNA,可以改造形成具有引导作用的gRNA (guide RNA),足以引导 Cas9 对 DNA 的定点切割。
作为一种 RNA导向的 dsDNA 结合蛋白,Cas9 效应物核酸酶是已知的第一个统一因子 (unifying factor),它能够共定位 RNA、DNA 和蛋白,从而拥有巨大的改造潜力。将蛋白与无核酸酶的 Cas9(Cas9 nuclease-null)融合,并表达适当的 gRNA,即可靶定任何 dsDNA 序列,而 RNA 可连接到gRNA 的末端,不影响 Cas9 的结合。因此,Cas9 能在任何 dsDNA 序列处带来任何融合蛋白及 RNA,这为生物体的研究和改造带来巨大潜力。
我公司提供专业优质的crispr/cas9载体构建技术服务,目标对象包括动物(人源细胞、鼠源细胞等)、植物(拟南芥、水稻、小麦、玉米等)、微生物(大肠杆菌、放线菌、梭菌等)。可将基因敲入/敲出细胞系、定点突变,公司拥有专业的仪器设备和技术人员支持,周期短,效果好,质量优,价格低。
技术特色
• 可实现多个基因位点及多个基因同时敲除;
• 最新的Nickase/双gRNA技术,显著降低脱靶率;
• 无种属限制,适用于各种植物的靶向敲除;
服务说明
• 客户需提供载体、含目的基因的质粒或cDNA模板、载体图谱与序列信息、目标蛋白基因序列与酶切位点信息。
• 请确认待实验的载体、目的基因片段序列正确,与提供的图谱等信息匹配,构建完成后如需测序并且要求序列完全匹配,则需要您提供全序列信息;
• 如果您只提供组织或细胞样本,请提供所需克隆基因的NCBI登录号或电子版全序列,本公司将额外收取RNA提取及逆转录的费用;
参考文献
1)Mojica FJ,Diez-Villaseñor CGarcía-Martínez ,et al. 2005 Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements.Journal ofMolecular Evolution.60(2):174-182.
2)BarrangouR,FremauxC,DeveauH,et al.2007 CRISPR provides acquired resistance against viruses in prokaryotes.Science,2007,315(5819):1709-1712.
3)GarneauJE,Dupuis MÈ,Villion M,et al.2010 The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA.Nature.468(7320):67-71.
4)Akashi H,Miyagishi M,Taira K. 2004 RNAi expression vectors in plant cells. Methods Mol Biol. 252:533-43.
5)Crowl R,Seamans C,Lomedico P, et al.1985 Versatile expression vectors for high-level synthesis of cloned gene products in Escherichia coli. Gene. 38(1-3):31-8.


