文献解读 | 上海农科院11.7分成果!一文讲透植物激素+多组学高分设计思路

植物领域的机制研究正从单一维度向系统化整合迈进,其中“激素检测+多组学+功能验证”的设计思路因其多层次解析能力,正逐步成为高分研究的核心策略。
植物激素检测通过高灵敏度质谱技术追踪植物激素代谢的时空变化,为信号网络提供定量基础;在此基础上整合其他多组学数据(转录组、蛋白组)则能全局性捕捉基因表达、蛋白互作与代谢重编程的协同模式,从海量数据中筛选关键调控节点。进一步拓展的功能验证环节,基因编辑、分子互作(如CO-IP、双荧光素酶系统)等实验,则能够在遗传与生化层面确证靶点功能,建立“激素-基因-表型”的完整假说验证,为文章的完成度再提高一个档次。这一设计思路突破传统单一技术的局限,其系统性、可验证性高度契合顶级期刊对创新性与完整性的要求,已成为揭示新机制、发表高分文章的有效路径。

水稻(Oryza sativa L.)是维持全球一半以上人口的主食。褐飞虱(BPH;Nilaparvata lugens Stål)是水稻特有的最臭名昭著的害虫。目前为止,已经鉴定出40多种褐飞虱抗性基因,这些褐飞虱抗性基因能够帮助水稻植物激活下游防御相关的信号通路,这些通路相互连接,使植物能够快速执行具有成本效益的反应。植物激素是植物发育和抵抗生物胁迫(如病原体和昆虫食草动物)以及非生物胁迫的免疫信号的重要调节因子。生长素在植物发育和生理的各种过程中起着广泛的作用。活性氧(ROS)的产生是植物在不同胁迫下激活的防御反应,然而,生长素信号和ROS在水稻褐飞虱相互作用中的作用仍然未知。
2025年5月16日,上海农业科学院作物育种与栽培研究所农业农村部粮油作物种质创新与遗传改良重点实验室,在 Science Advances杂志上发表了题为“The microRNA OsmiR393 regulates rice brown planthopper resistance by modulating the auxin–ROS signaling cross-talk”的文章,本研究发现了生长素和ROS之间的串扰,揭示了BPH抗性背后复杂的信号网络,这有助于BPH抗性的育种。

研究对象:水稻
技术方法:植物激素含量检测、基因编辑、qRT-PCR、miRNA Northern blot、CO-IP、BiFC、Y2H、Dual-LUC等
1.生长素信号激活水稻对褐飞虱的抗性
为了评估生长素在水稻抗褐飞虱中的作用,在褐飞虱处理之前用生长素类似物萘乙酸(NAA)处理水稻幼苗。7至10天后,所有未经NAA处理的植物死亡,0.1μM NAA处理的植株仍然存活,而用1μM NAA治疗的大多数植株也死亡了(图1A),存活率表明低浓度NAA激活了BPH抗性(图1B),但当NAA浓度升高时,促进作用下降(图1C),因此存活率较低(图1D),证实较高浓度NAA处理抑制了水稻植物的褐飞虱抗性。同时,使用抗褐飞虱水稻品种“Rathu Heenati”(RHT)和褐飞虱易感品种“9311”植株,测量了褐飞虱侵染后内源IAA含量。在这两个品种中,IAA含量在BPH侵染后12和24小时下降,RHT的下降幅度大于9311(图1,E和F)。因此,BPH侵染降低了寄主植物中的IAA含量。
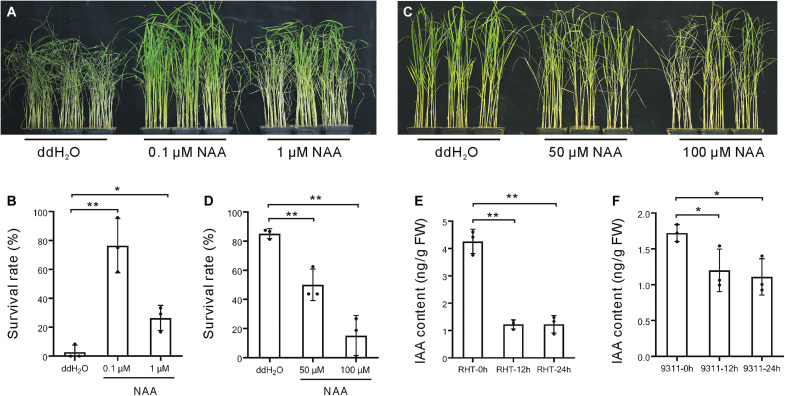
图1 生长素与水稻褐飞虱侵染的关系
两种主要的水稻生长素受体编码基因OsTIR1和OsAFB2的表达受BPH侵染诱导,所以构建了OsTIR1和OsAFB2过表达的转基因植物(分别为TIR1OE和AFB2OE)(图2,A和B)和编辑的植物(分别是TIR1KO和AFB2KO)。TIROE-1植物的死亡时间都晚于野生型(WT)植物(图2E和F),并且TIROE-1植物在BPH侵染后的存活率远高于WT(图2G)。同样,TIROE-2植物比WT植物死亡晚(图2,H和I),总体存活率更高(图2J)。相比之下,TIR1KO-1(图2,K和L)和TIR1KO-2植物(图2中,K和N)比野生型植物更早死亡,各自的存活率远低于野生型(图2中的M和O)。AFB2KO-1(图2,P和Q)和AFB2KO-2植株(图2、P和S)比野生型植株早死亡,两个品系的存活率都比野生型低得多(图2:R和T)。因此,生长素激活BPH抗性可能是由OsTIR1和OsAFB2受体介导的。
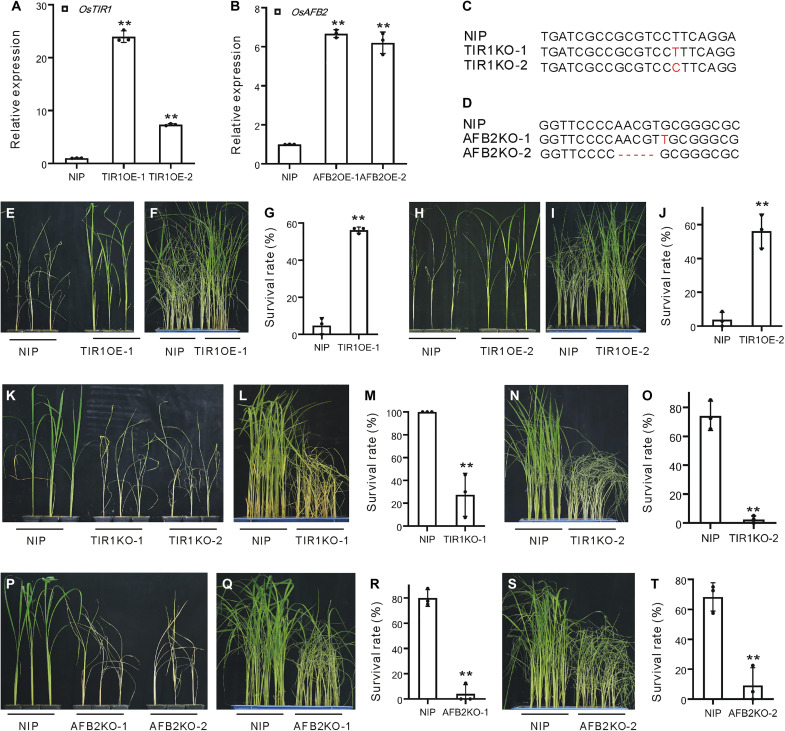
图2 TIR1OE、TIR1KO、AFB2OE和AFB2KO植物的褐飞虱抗性
2.OsmiR393对生长素信号传导进行转录后调控,并对BPH抗性产生负面影响
为了研究OsmiR393在BPH抗性中的作用,在“日本晴”(NIP)遗传背景下构建了OsMIR393a和OsMIR393b过表达和敲除植物,并进行了验证(图3)。
在个体和小群体试验中,OsmiR393过表达的植物都比野生型植物死亡得早得多(图4A至I),表明其易患BPH。OsmiR393双敲除植物植株比野生型植株晚死亡,表明对褐飞虱的抗性增强(图4J至O),因此,OsmiR393a和OsmiR393b双敲除植物对褐飞虱的抗性增强。
与NIP植物相比,以393bOE植物为食的BPH个体排泄的蜜露量要高得多,而以393DKO-1植物为食料的BPH排泄的蜜露量则大大减少(图4P)。综上所述,这些结果表明生长素信号通路受OsmiR393的转录后调控,OsmiR393负调控水稻对褐飞虱的抗性。
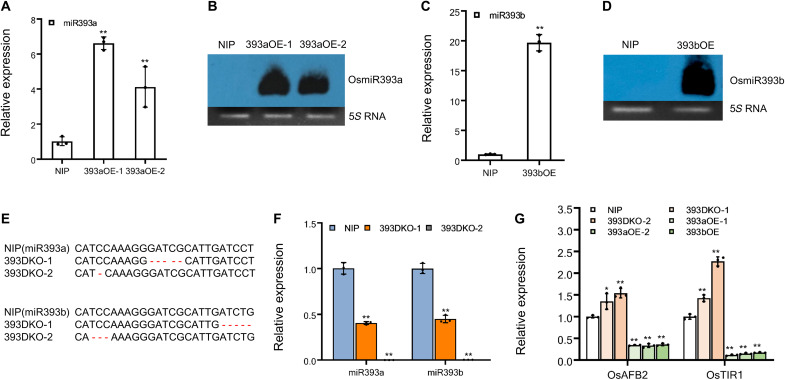
图3 393aOE、393bOE和393DKO的验证和检测
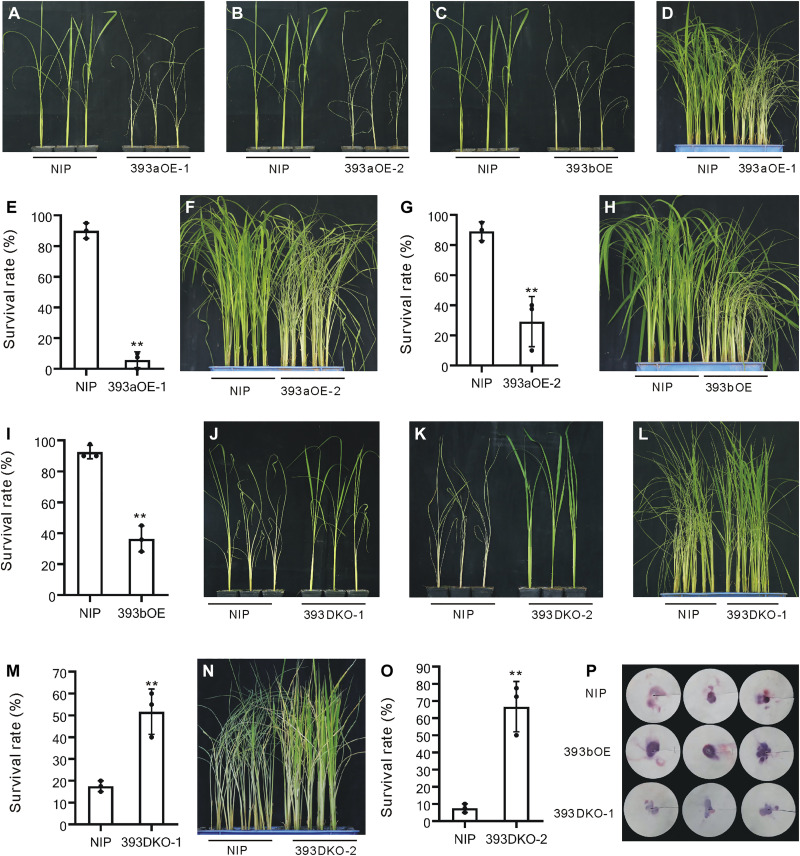
图4 393aOE、393bOE和393DKO植株与野生型植株的褐飞虱抗性比较
3.OsIAA10与OsTIR1相互作用介导BPH抗性
酵母双杂交(Y2H)试验发现许多OsIAA在酵母系统中与OsTIR1-相互作用(图S2)。进一步实验证明OsIAA2、OsIAA7、OsIAA10、OsIAA16和OsIAA24基因在393DKO-1植株中下调,但在393bOE植株中上调(图5A)。响应性表达分析显示,这些基因对BPH感染敏感,OsIAA10表现出最强的诱导反应(图5B)。在个体试验和小群体试验中,IAA10KO-1和IAA10KO-2植株(12株)比“中华11号”(ZH11)野生型植株晚死亡(图5,C,D和F),其各自的存活率高于小群体试验(图5、E和G)中的野生型植株。IAA10OE-1和IAA10OE-2植物比野生型植物更早死亡(图5,H、I和K),它们各自的存活率低于小群体试验的野生型(图5、J和L)。因此,OsIAA10负调控BPH抗性。
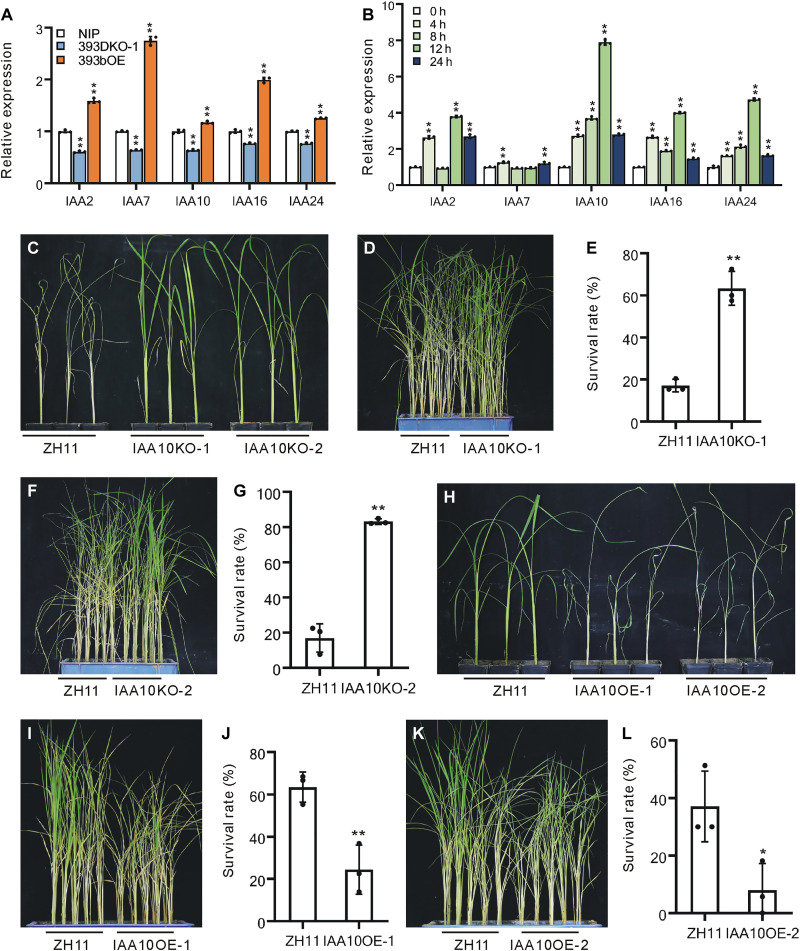
图5 OsIAA基因的表达及OsIAA10的遗传功能分析
4.OsARF12在OsTIR1/OsIAA10的下游介导BPH抗性
在Y2H测定中,携带OsIAA10和OsARF12的酵母在SD/-T-L-H-A培养基上生长良好(图6A)。此外,OsIAA10和OsARF12之间的相互作用在LCI(图6B)、BiFC(图6C)和共免疫沉淀(co-IP)检测中得到了验证(图6D)。所有这些生化分析表明,OsIAA10在体外和体内与OsARF12相互作用。因此,OsTIR1/OsIAA10模块可能通过OsARF12发挥作用,介导下游生长素信号传导。
在个体和小群体试验的测试中,ARF12过表达和敲除植株的死亡时间和存活率统计以及BPH个体排泄的蜜露量统计结果表明,OsARF12正向调节BPH抗性(图6E-P)。在单独测试中,杂交植物393DKOk/ARF12KOk比393DKOk植物更容易感染BPH,其状态与野生型植物相似(图6Q)。因此,393DKOk植株的褐飞虱抗性依赖于OsARF12基因。
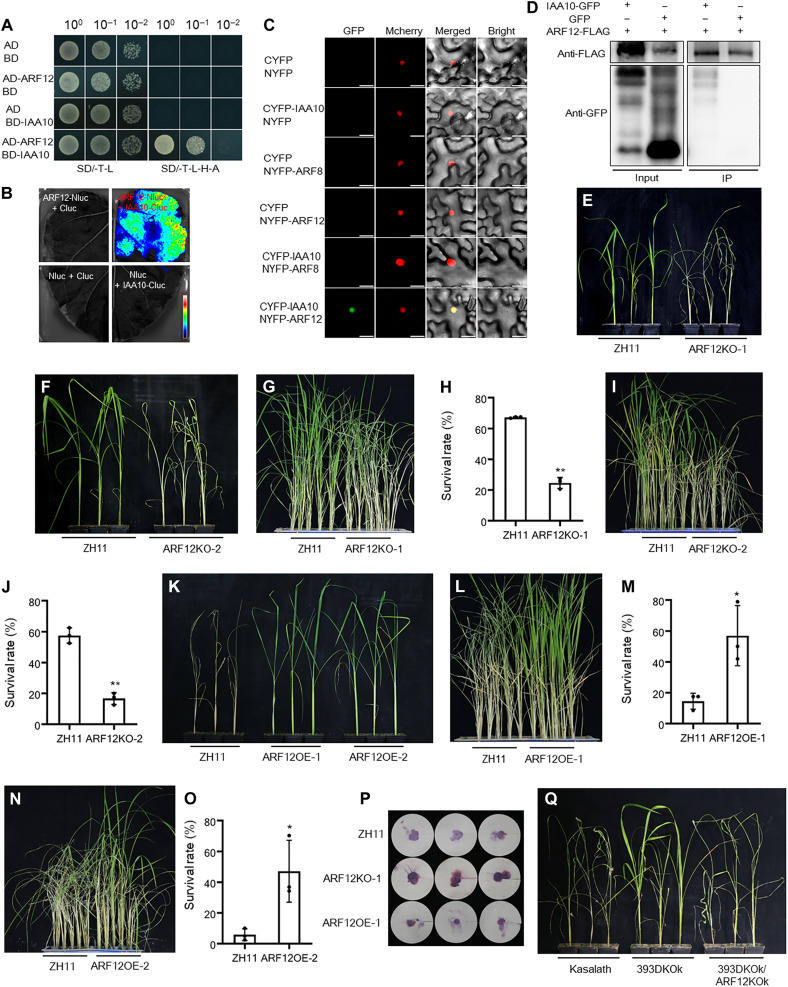
图6 OsIAA10和OsARF12的相互作用验证以及OsARF12的遗传功能分析
5.OsARF12基因激活下游基因OsRbohB
BPH感染严重影响了七个基因的表达,其中OsRbohB的诱导是最明显的变化(图7A)。利用OsRbohB突变体的BPH抗性来研究OsRbohB在BPH抗性中的作用。在BPH侵染之前,osrbohB突变体中的H2O2含量低于NIP,如3,3′-二氨基联苯胺(DAB)染色和H2O2含量测量所示(图7,B和C)。BPH侵染激活了osrbohB突变体和NIP植物中H2O2的积累,但osrbohB突变体植物中的激活程度与NIP植物不可比(图7,B和D)。因此,OsRbohB基因通过H2O2的积累正向调节BPH抗性。
利用GAL4系统检测OsARF12的转录激活效果,将OsARF12的全长编码序列与GAL4BD融合,并在35S启动子的控制下进行表达。结果显示,GAL4BD-ARF12的荧光素酶活性明显高于负对照,表明OsARF12具有转录激活功能。接着,通过表达分析发现ARF12过表达(ARF12OE)的植物中OsRbohB基因上调,而在ARF12缺失(ARF12KO)的植物中则下调,提示OsARF12可能调控OsRbohB。此外,在393DKO(双基因缺失)植物中OsRbohB上调,而在393aOE和393bOE植物中下调,表明OsRbohB可能参与OsmiR393介导的信号通路。还确认了OsARF12能够结合OsRbohB启动子的DNA结合位点,并且能够激活其表达。
为了进一步验证OsRbohB基因在OsmiR393/OsTIR1-OsIAA10-OsARF12通路中介导BPH抗性的作用,在ARF12KO-1背景中过表达OsRbohB,发现这些转基因植物对BPH的抗性得以恢复。此外,通过对393DKO-1植物进行OsRbohB敲除实验,结果显示393DKO-1/RbohBKO植物对BPH更加敏感,表明393DKO-1植物的抗性依赖于OsRbohB基因。
总结来说,研究表明OsARF12直接激活OsRbohB基因的表达,进而在OsmiR393/OsTIR1-OsIAA10-OsARF12信号通路中发挥作用,增强水稻对BPH的抗性。
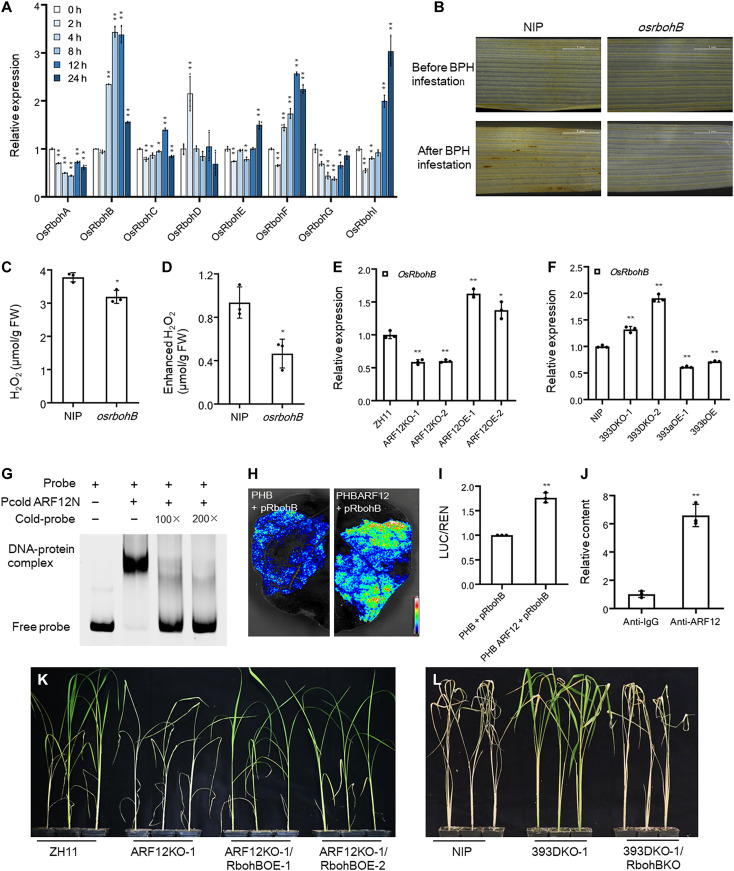
图7 OsARF12对OsRbohB的转录调控,OsRbohB的遗传功能分析,及其与OsARF12和OsmiR393的遗传关系
6.ROS参与OsmiR393/OsTIR1信号介导的BPH耐药性
首先,研究表明ROS在植物防御反应的下游信号机制中发挥广泛作用。为了验证ROS是否在BPH抗性中起重要作用,首先用H2O2处理水稻植物,发现经过处理的植物在BPH侵染后存活率显著提高,且浓度越高,存活率越高。接着,测量了不同水稻品种中H2O2的含量,发现抗性品种RHT的基础H2O2含量高于易感品种9311,且在BPH侵染后,RHT的H2O2含量大幅上升,而9311的上升幅度则相对较小。
此外,还测量了过表达OsmiR393和基因编辑植物的H2O2含量,发现393DKO-1植物的H2O2含量明显高于NIP,而393bOE植物的基础H2O2含量与NIP相似。BPH侵染后,所有检测植物的H2O2含量均增加,393DKO-1植物的增加幅度显著高于NIP,而393bOE植物的增加幅度低于NIP。另一方面,OsARF12过表达及基因编辑植物的H2O2含量也被测量,结果显示ARF12OE植物的基础H2O2含量高于ZH11,而ARF12KO植物则低于ZH11。在BPH侵染后,这些植物的H2O2含量均有所增加,ARF12OE植物的增加幅度高于ZH11。
接下来调查了几种基因改造植物中几丁质是否能诱导ROS的产生,发现转换了OsmiR393/OsTIR1-OsIAA10-OsARF12信号通路的植物(如393DKO、TIR1OE、IAA10KO和ARF12OE)中,几丁质诱导的ROS产生增强,而393aOE、393bOE、TIR1KO、IAA10OE和ARF12KO植物中则ROS产生受到抑制。这表明ROS激活与BPH抗性之间关系密切,并且这一激活与OsmiR393/OsTIR1-OsIAA10-OsARF12-OsRbohB信号通路紧密相关。
研究者还测试了BPH抗性与ROS之间的关联,发现ARF12KO-1植物的BPH易感性可通过OsRbohB过表达得到补救,同时ARF12KO-1植物中低ROS水平得以恢复。此外,393DKO-1/RbohBKO植物对BPH的抗性较393DKO-1植物差,并且在393DKO-1/RbohBKO植物中,几丁质诱导的ROS产生也表现出显著下降。最后,研究证明OsmiR393在遗传上调控OsARF12以介导BPH抗性,同时在393DKO/ARF12KO植物中,几丁质诱导的ROS产生低于393DKO植物,进一步支持这一遗传关联。
总结而言,ROS在水稻对BPH的抗性中发挥关键作用,且通过OsmiR393、OsARF12和OsRbohB等基因间的相互作用,调控ROS的产生,从而增强植物的抗病能力。
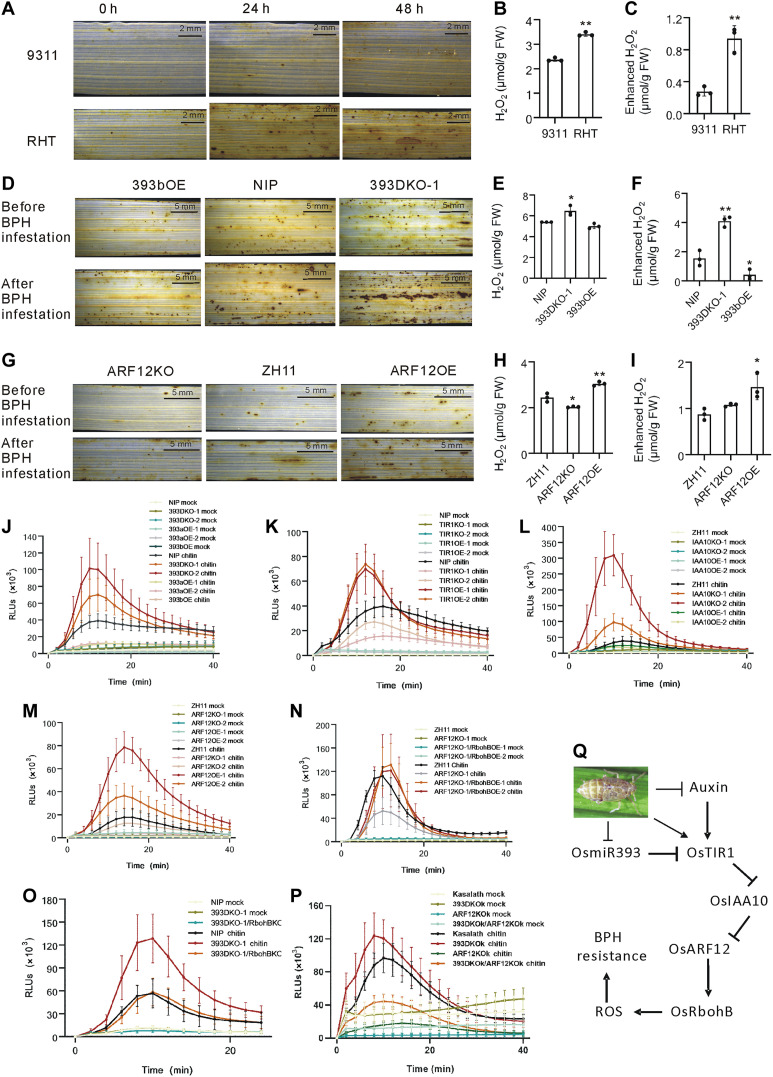
图8 OsmiR393/TIR1-OsIAA10-OsARF12-OsRbohB通路中的ROS含量对BPH感染的反应
在褐飞虱和水稻之间的相互作用中,褐飞虱扰乱了IAA途径,降低了寄主植物活力,导致IAA含量降低。作为一种抵消反馈机制,IAA含量的降低可能会激活水稻植株中的先天IAA信号通路,促进OsTIR1/OsAFB2的表达和功能,激活OsARF12,而抑制OsIAA10的表达。增强的生长素信号传导进一步促进ROS积累,从而增强防御反应。

作为国内领先的植物靶向检测服务供应商,为向广大科研工作者提供更全面、高质量的植物激素检测数据,三黍生物正式推出九大类植物激素检测升级版服务,新增独脚金内酯等检测项目!
升级后服务单次送样即可获得九大类激素,超50种物质靶向检测数据,避免多次送样,维持原有收费标准,加量不加价!
植物激素检测服务升级预售期间(即日起至2025年5月31日止),凡下单植物激素靶向检测服务,即可解锁三重预售福利:
下单自动升级为九大类植物激素检测新版本服务!
支持拼单尝鲜(免标曲费)下单优惠!
享受10个工作日优先排单专属特权!
福利限时有效,发送私信或联系您的客户经理即可领取~
| 三黍服务 | 三黍服务 |
植物激素含量测定 (正/负/双模式) | |
赤霉素含量测定(16种) | |
油菜素甾醇测定(11种) | |
单宁单体含量测定 | 维生素B族含量分析 (正/负/双模式) |
多酚单体含量测定 | |
酚酸单体含量测定 (结合型) | |
绿原酸单体含量测定 | 可溶性糖单体含量测定 (ICS) |
花青素单体含量测定 | |
花青素非靶定性检测 | |
更多检测项目,欢迎私信详询! | |
注:三黍生物对上述活动保留最终解释权,详情请咨询。

排版:野凌
审核:三黍生物企宣部


