苍术, 多糖, 中药多糖, 肠道, 免疫抑制, 肠道损伤, 免疫调节, 功能性多糖
一作解读 | 苍术多糖缓解化疗副作用功能拿下IF 6.5,作者亲授多糖结合免疫热点研究方法!

化疗作为治疗恶性肿瘤的主要手段之一,在一定程度上能有效抑制恶性肿瘤细胞的生长和转移,然而化疗在杀伤肿瘤细胞的同时,对机体正常细胞也会造成严重损伤。环磷酰胺作为临床常用的抗肿瘤化疗药,对恶性肿瘤疗效显著,然而,环磷酰胺会引发免疫抑制、肠道黏膜损伤等多种毒副作用。因此,急需寻找安全有效的免疫调节剂来缓解环磷酰胺诱导的免疫抑制和肠道黏膜损伤,这对于肿瘤的临床治疗具有重要的现实意义。
苍术为菊科植物茅苍术或北苍术的干燥根茎,前期研究表明,与生苍术粗多糖相比,麸炒苍术粗多糖肠道保护活性更好。然而,麸炒苍术均一多糖结构特征尚不明确,且发挥肠道保护活性的作用机制尚未得到充分研究。本研究从麸炒苍术中分离纯化得到一种均一多糖FALP-A1,并探究其免疫调节及肠道保护活性。本研究明确了麸炒苍术均一多糖的结构特征及潜在的免疫调节机制,有望为苍术多糖作为增强肠道免疫的候选药物提供实验依据和新的研究思路。

麸炒苍术、RAW264.7细胞、C57BL/6J小鼠
分子量、单糖组成、紫外光谱、红外光谱、扫描电镜、甲基化分析、核磁共振波谱、细胞活力测定、HE染色、免疫荧光、免疫组化、蛋白免疫印记
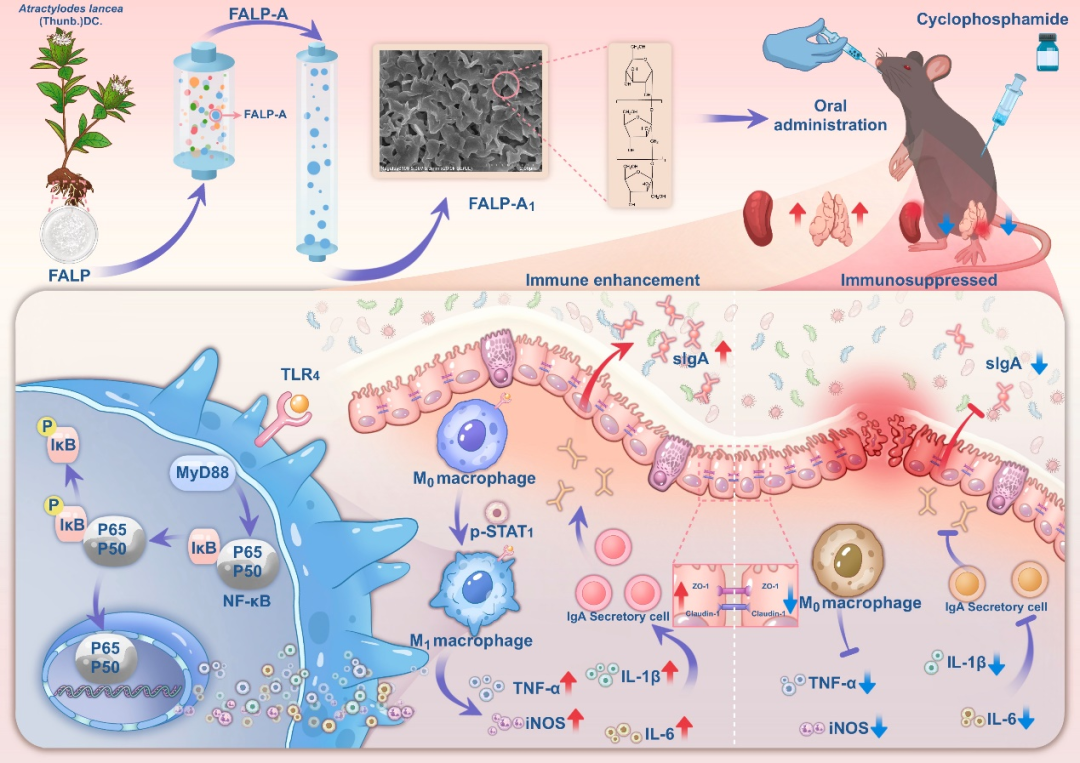
图1. 技术路线
麸炒苍术多糖的提取、分离和纯化过程如图1所示,从麸炒苍术中提取粗多糖,命名为FALP,对其进行分离纯化,得到FALP-A1。FALP-A1的化学组成如表1所示。
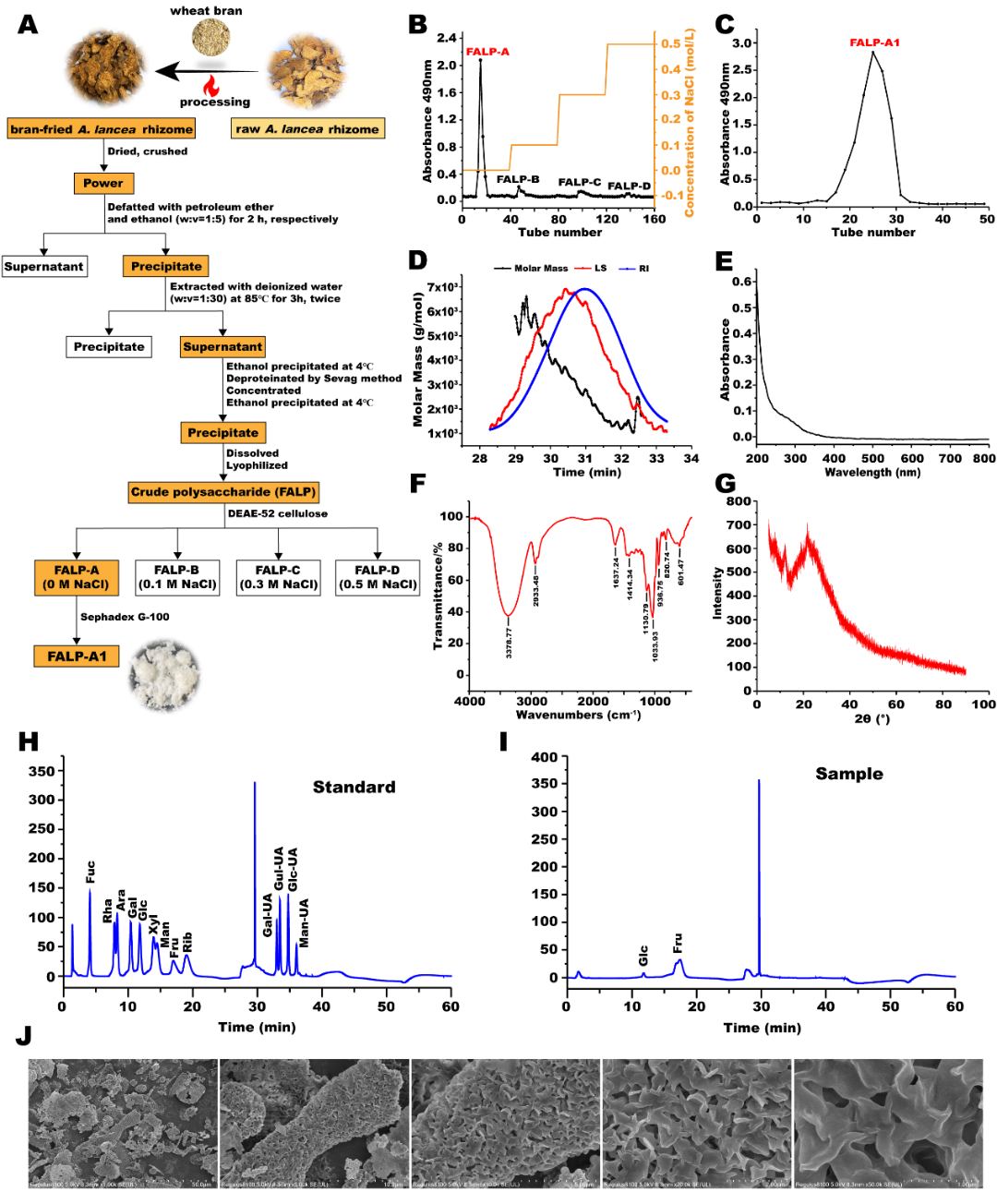
图2. FALP-A1分离纯化与结构表征
Table 1. Chemical composition for FALP-A1.

FALP-A1呈现对称的单峰,表明FALP-A1的均一性良好。FALP-A1的数均分子量(Mn)为2.321 Da;重均分子量(Mw)为2.867 Da;峰值分子量(Mp)为2.768 Da,其分散性指数(Mw/Mn)为1.235,如表2所示。
Table 2. Molecular characteristics of FALP-A1.

FALP-A1在260nm和280nm没有明显的吸收峰,表明不含核酸和蛋白质。FALP-A1在3378.77cm-1附近宽而强的吸收峰归因于O-H的伸缩振动,2933.48 cm-1处的峰归因于甲基和亚甲基的C-H的伸缩振动,上述结果表明FALP-A1具有多糖的特征吸收峰。1130.79 cm-1和1033.93 cm-1处的强烈吸收归因于糖环中C-O-C或C-O-H的伸缩振动。936.75 cm-1和820.74 cm-1处的吸收峰表明存在β构型糖苷键的果糖。1740 cm-1没有吸收峰,表明FALP-A1不含糖醛酸。
FALP-A1在衍射角2θ 5~90°的范围内不存在明显的强衍射吸收峰,表明FALP-A1为非结晶物质,在常态下不能形成单晶,属于无定形态。
FALP-A1由果糖和葡萄糖组成,摩尔比为97.58∶2.42。
FALP-A1在低倍镜下呈现表面粗糙且不规则的片状结构,略有碎屑。在高倍镜下,粗糙面被放大,呈现鳞片状的片层结构,表面层次不一,结构相对致密。
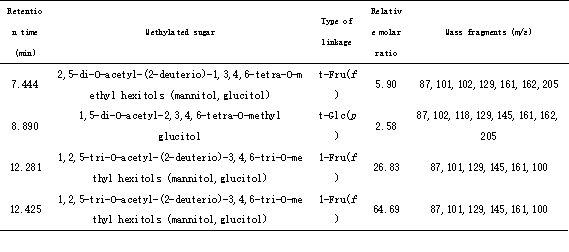
通过GC-MS分析,鉴定出4种部分甲基化的糖醇乙酸酯:2,5-di-O-acetyl-(2-deuterio)-1,3,4,6-tetra-O-methyl hexitols (mannitol,glucitol),1,5-di-O-acetyl-2,3,4,6-tetra-O-methyl glucitol,1,2,5-tri-O-acetyl-(2-deuterio)-3,4,6-tri-O-methyl hexitols (mannitol,glucitol),1,2,5-tri-O-acetyl-(2-deuterio)-3,4,6-tri-O-methyl hexitols (mannitol,glucitol),其相对摩尔比分别为:5.90∶2.58∶26.83∶64.69,如表3所示。
Table 3. GC–MS data for methylation analysis of FALP-A1.
FALP-A1在δ4.5-5.3 ppm无显著吸收峰(其中δ4.71 ppm为HOD溶剂峰),这与果糖信号一致,表明FALP-A1中含有果糖结构。δ5.33 ppm处有一个弱吸收峰,归属于α-D-Glcp-1→的异构体氢。13C NMR spectrum在异头碳信号区出现3个信号峰,δ103.17ppm和δ103.63ppm归属于果糖残基,而δ92.39ppm归属于葡萄糖残基。同时,根据FALP-A1的COSY spectrum, NOESY spectrum, HSQC spectrum, HMBC spectrum,对1H和13C NMR的化学位移进行了归属,如表4所示。结合HSQC spectrum和文献报道,推断糖残基A可能为→1)-β-D-Fruf-(2→。同理,可推测糖残基B可能也是果糖残基,结合甲基化分析结果和文献报道,推断糖残基B可能为β-D-Fruf-(2→。对于糖残基C,结合甲基化分析结果和文献报道,推断糖残基C可能为α-D-Glcp-(1→。通常情况下,菊粉型果聚糖的特点是其末端存在葡萄糖残基,结合甲基化结果,FALP-A1可能是一种菊粉型果聚糖。综合1D和2D的NMR光谱信息以及甲基化分析结果,推断FALP-A1主要是由→1)-β-D-Fruf-(2→和少量β-D-Fruf-(2→, α-D-Glcp-(1→相互连接形成的直链结构,FALP-A1可能的结构式如图2G所示。
Table 4. 1H and 13C NMR chemical shifts of FALP-A1.
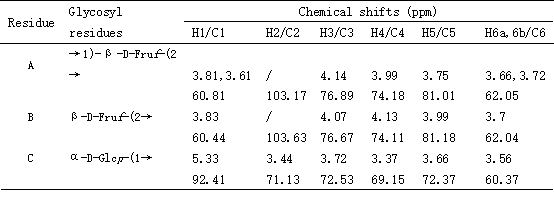
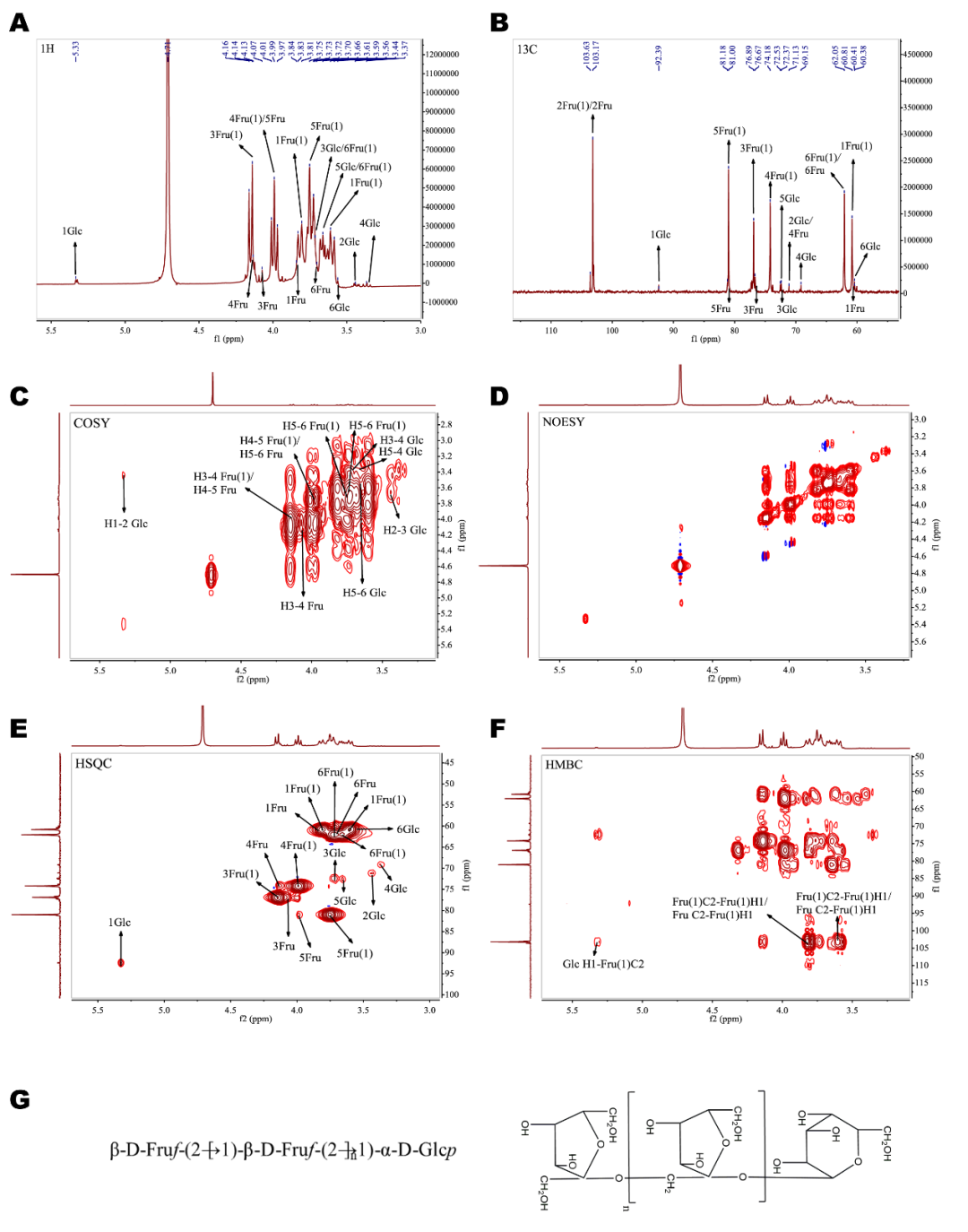
图3. FALP-A1核磁共振波谱分析
FALP-A1在50-2000 μg/mL的浓度下对RAW264.7细胞活力无显著影响,在50-400 μg/mL的浓度下剂量依赖性增强RAW264.7细胞的吞噬率。
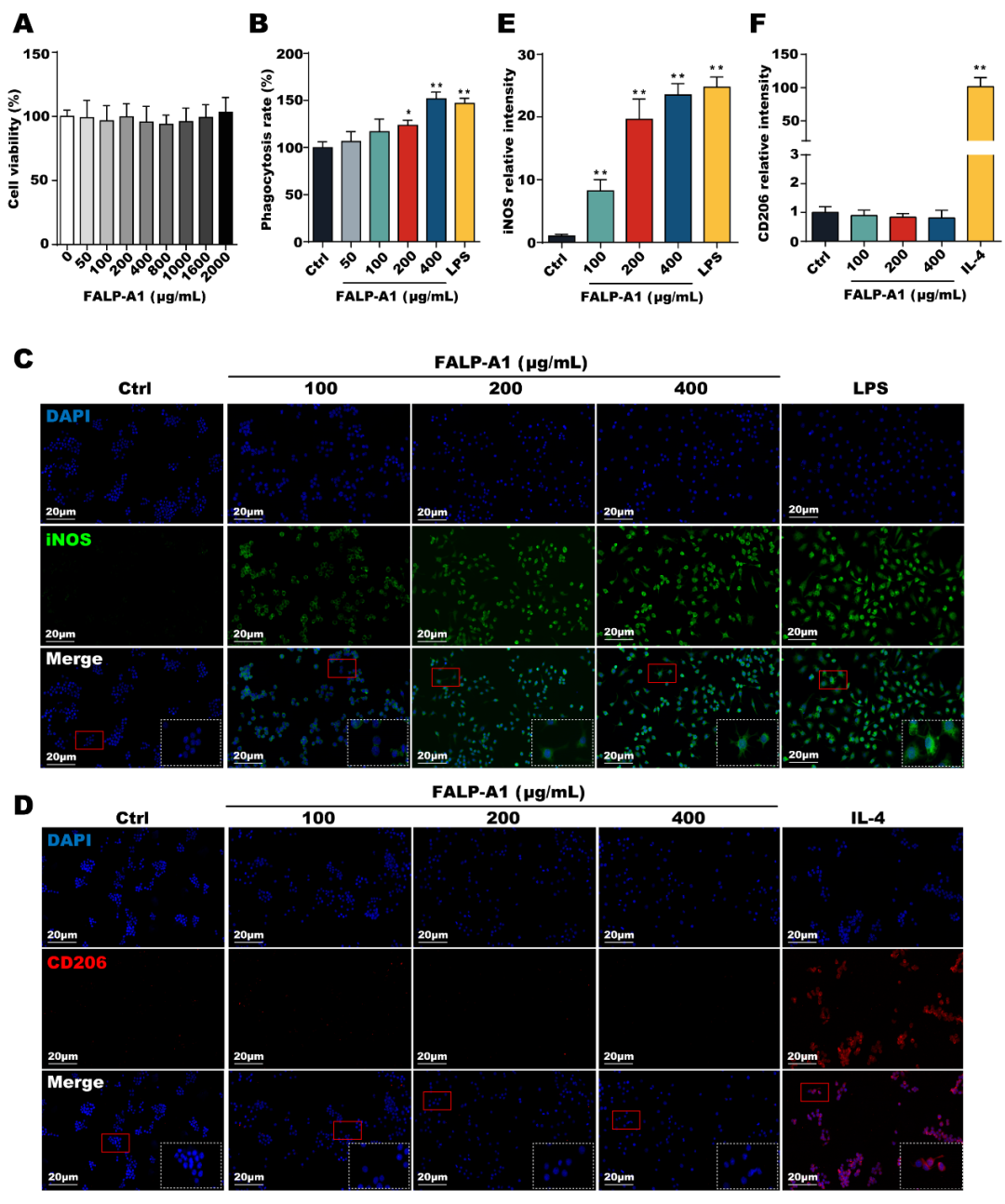
图4.FALP-A1促进RAW264.7细胞向M1型巨噬细胞极化
FALP-A1显著促进M1型巨噬细胞标志物iNOS的表达,然而,FALP-A1对M2型巨噬细胞标志物CD206的表达无显著影响。FALP-A1促进M1型巨噬细胞相关细胞因子TNF-α、IL-1β、IL-6和iNOS的表达水平,但对M2型巨噬细胞相关细胞因子CD206和TGF-β的表达水平无显著影响,ELISA结果与RT-qPCR结果一致。此外,FALP-A1还能促进p-STAT1的表达。
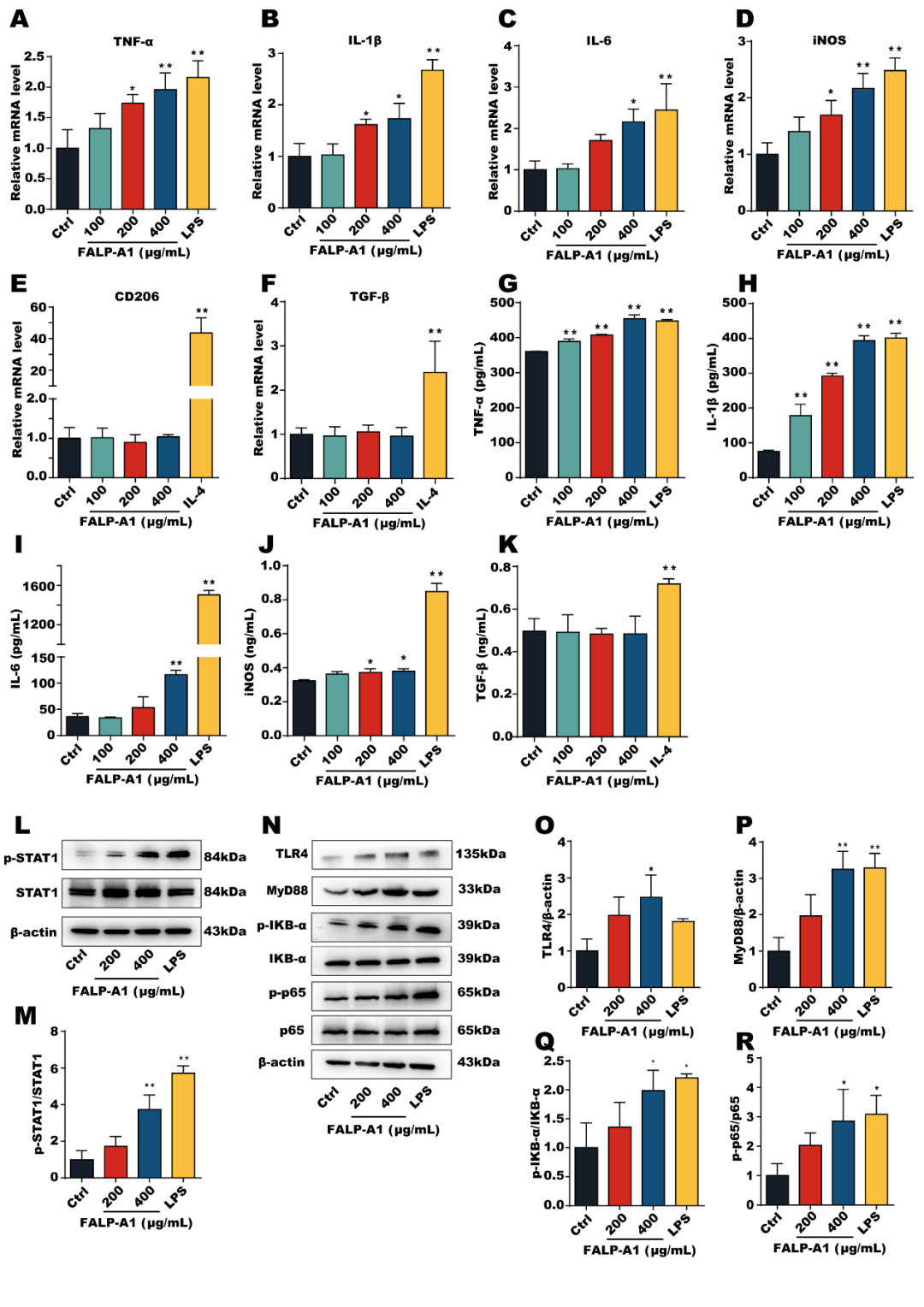
图5.FALP-A1调节细胞因子分泌并激活 TLR4/MyD88/NF-kB信号通路
FALP-A1呈剂量依赖性上调了TLR4、MyD88、p-IKB-α和p-p65的表达水平。上述结果表明,FALP-A1可以通过激活TLR4/MyD88/NF-kB信号通路,从而促进巨噬细胞向M1型极化,这可能是FALP-A1发挥免疫调节作用的机制之一。
结果表明,给与FALP-A1治疗后,小鼠体重显著增加,脾脏指数和胸腺指数均有不同程度的回升。FALP-A1显著改善脾脏和胸腺组织结构。此外,FALP-A1还能增加腹腔巨噬细胞的吞噬率和吞噬指数。
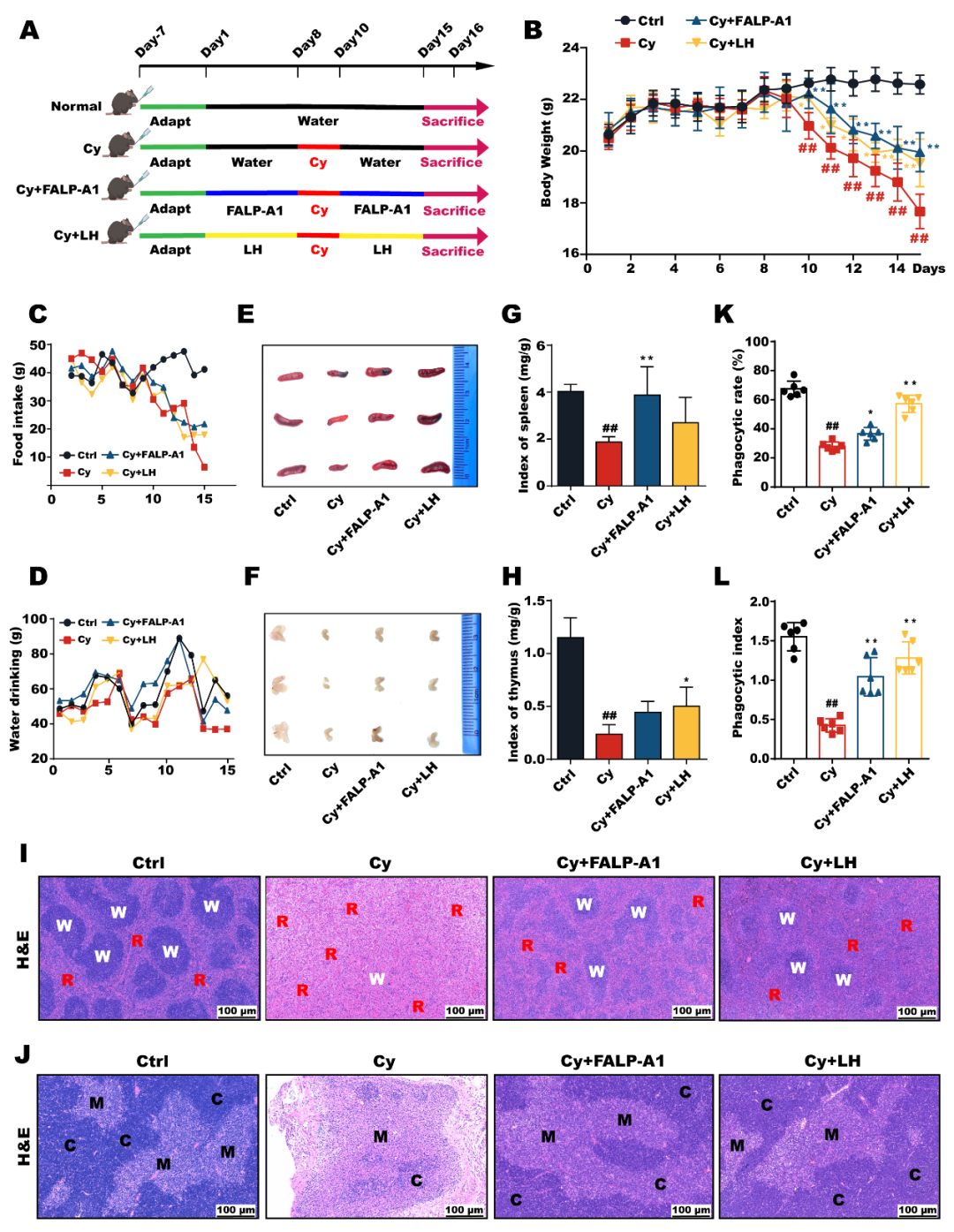
图6.FALP-A1缓解环磷酰胺诱导的免疫抑制症状
HE染色结果表明,给与FALP-A1治疗后,肠道损伤情况明显改善,肠道组织结构相对完整,FALP-A1不仅降低了肠道组织病理学评分和隐窝深度,同时还增加了绒毛长度以及绒毛长度和隐窝深度的比值。FALP-A1还能显著上调ZO-1和Claudin-1的表达。
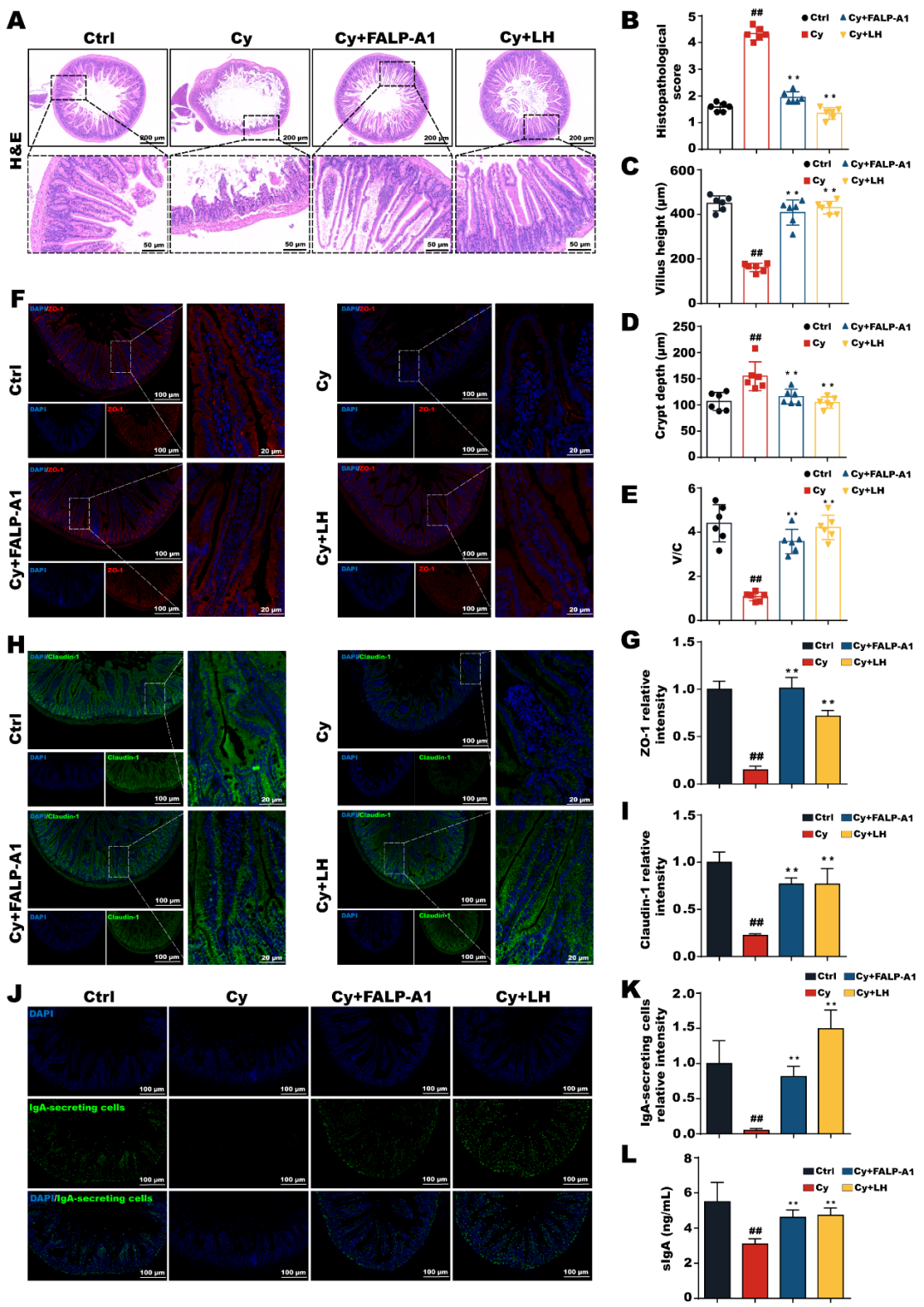
图7.FALP-A1改善小鼠肠道损伤并增强肠道免疫
给与FALP-A1治疗后,显著增加了IgA分泌细胞的表达水平。值得注意的是,sIgA的表达水平与IgA分泌细胞的表达水平一致。
给与FALP-A1后,显著上调了M1型巨噬细胞标志物iNOS的表达,而FALP-A1对M2型巨噬细胞标志物CD206的表达无显著影响。此外,FALP-A1显著逆转M1型巨噬细胞因子的降低情况,而对M2型巨噬细胞相关细胞因子TGF-β的表达水平无显著影响。FALP-A1治疗后显著增加了p-STAT1的表达水平,这与体外研究结果一致。
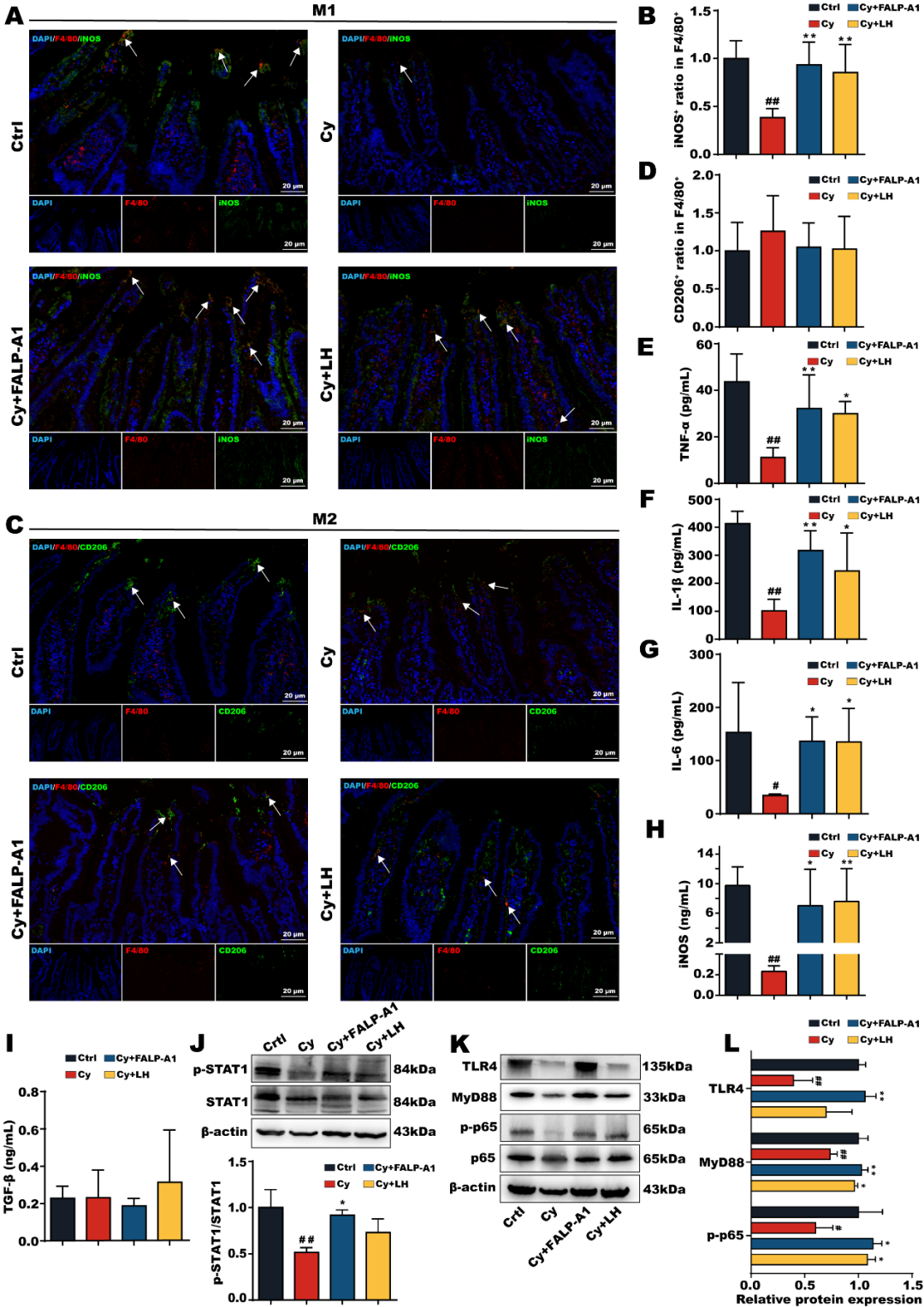
图8.FALP-A1激活TLR4/MyD88/NF-kB信号通路促进肠道巨噬细胞向M1型极化
为了进一步研究FALP-A1促进肠道巨噬细胞向M1型极化的机制,检测了TLR4/MyD88/NF-kB信号通路上相关蛋白的表达水平。结果表明FALP-A1显著增加免疫抑制小鼠肠道TLR4、MyD88和p-p65的表达水平。上述结果表明,FALP-A1通过激活TLR4/MyD88/NF-kB信号通路,促进免疫抑制小鼠肠道巨噬细胞向M1型极化,从而发挥免疫调节作用。
总之,本研究首次从麸炒苍术中分离纯化出一种均一的菊粉型果聚糖FALP-A1,并初步阐明了FALP-A1的结构特征及潜在的免疫调节机制。FALP-A1由果糖和葡萄糖组成,摩尔比为97.58∶2.42,该多糖骨架主要由→1)-β-D-Fruf-(2→和少量β-D-Fruf-(2→, α-D-Glcp-(1→连接而成。体外和体内实验表明FALP-A1不仅可以增强巨噬细胞的吞噬活性,还能改善环磷酰胺诱导的免疫抑制和肠道黏膜损伤。此外,FALP-A1还能通过促进IgA分泌细胞的表达和sIgA的分泌来增强肠道黏膜免疫,其作用机制可能与激活TLR4/MyD88/NF-kB信号通路从而促进巨噬细胞向M1型极化有关。本研究首次阐明了FALP-A1在免疫调节和肠道黏膜保护中的巨大潜力,这不仅为临床缓解化疗所致的毒副作用提供了新的治疗策略,还有助于促进含有天然来源多糖的药物和功能性食品的开发和应用。
多糖作为生命活动的关键物质,在医药、食品、农业领域应用前景广阔。随着国家生物经济战略推进,多糖产业正迎来千亿级市场机遇,但技术转化瓶颈亟待突破。
在多方机构支持下,“糖探未来”——首届全国功能性多糖挑战赛正式启动!
指导单位:台州市黄岩区人民政府
主办单位:中国生物工程学会中药生物技术专业委员会、国家技术转移东部中心、中国医药教育协会微生态与健康专业委员会
承办单位:江苏三黍生物科技有限公司
协办单位:上海知耕科技服务有限公司
合作媒体:枫林糖话
本次大赛旨在搭建“产学研用”一体化平台,通过竞赛加速多糖技术从实验室走向市场,同步推动多糖产业生态建设。
参赛者:本次活动面向所有功能性多糖相关研究人员(不限高校、科研机构、企业研发团队或个人)开放报名。
参赛作品内容:参赛者所提交用于本次活动参赛的作品,需围绕功能性多糖的提取纯化、结构解析、活性研究、产品开发、应用场景拓展等方向展开。可涵盖但不限于医药领域(如多糖药物研发、免疫调节制剂)、食品领域(如功能性食品添加剂、保健品)、农业领域(如植物免疫诱抗剂、生物肥料)等应用方向。需重点突出研究内容的商业价值或学术价值,突出研究内容的创新性。参赛作品必须为参赛者独立完成或团队合作的原创成果,未侵犯任何第三方知识产权。
本次大赛共评选奖项10名,发放奖金并对接配套资源。
最具商业价值奖 30,000元
最具学术价值奖 10,000元
最佳创新创意奖 10,000元
最佳人气奖 10,000元
优胜奖(6名) 2,000元
更有本次大赛专属权益加码:
百万政府支持资金;
万元人才补贴;
配套企业场地支持;
基础研究资金及技术支持;
专利合作优先权
……
本次活动共分为征集、初赛及决赛三阶段进行。
活动时间:即日起-2025年10月14日
点击下方卡片,关注“三黍生物”公众号,私信发送关键词“功能性多糖”获取活动报名表,并根据提示发送相关资料至指定邮箱。
活动时间:2025年10月
参赛作品初评采取网络投票+专家评审并行方式,为参赛作品提供公开平台高曝光度和领域内专家交流机会,从科学性、创新性、应用性等角度评选出前十名作品,进入决赛。
活动时间:2025年11月
由政府、科研单位、投资机构和相关企业组成的评审委员会,从文章学术价值、技术创新性、商业化可行性和市场潜力等角度,综合评选出最具商业价值奖、最具学术价值奖、最佳创新创意奖等奖项,并提供后续相应产业转化对接、项目产业化资金/政策等支持。
寻找学术与商业价值交点,让创新力转化为产业驱动力!
大赛作品征集通道开放中
欢迎投稿参赛,向世界展示您的智慧结晶!

排版:野凌
审核:三黍生物企宣部


