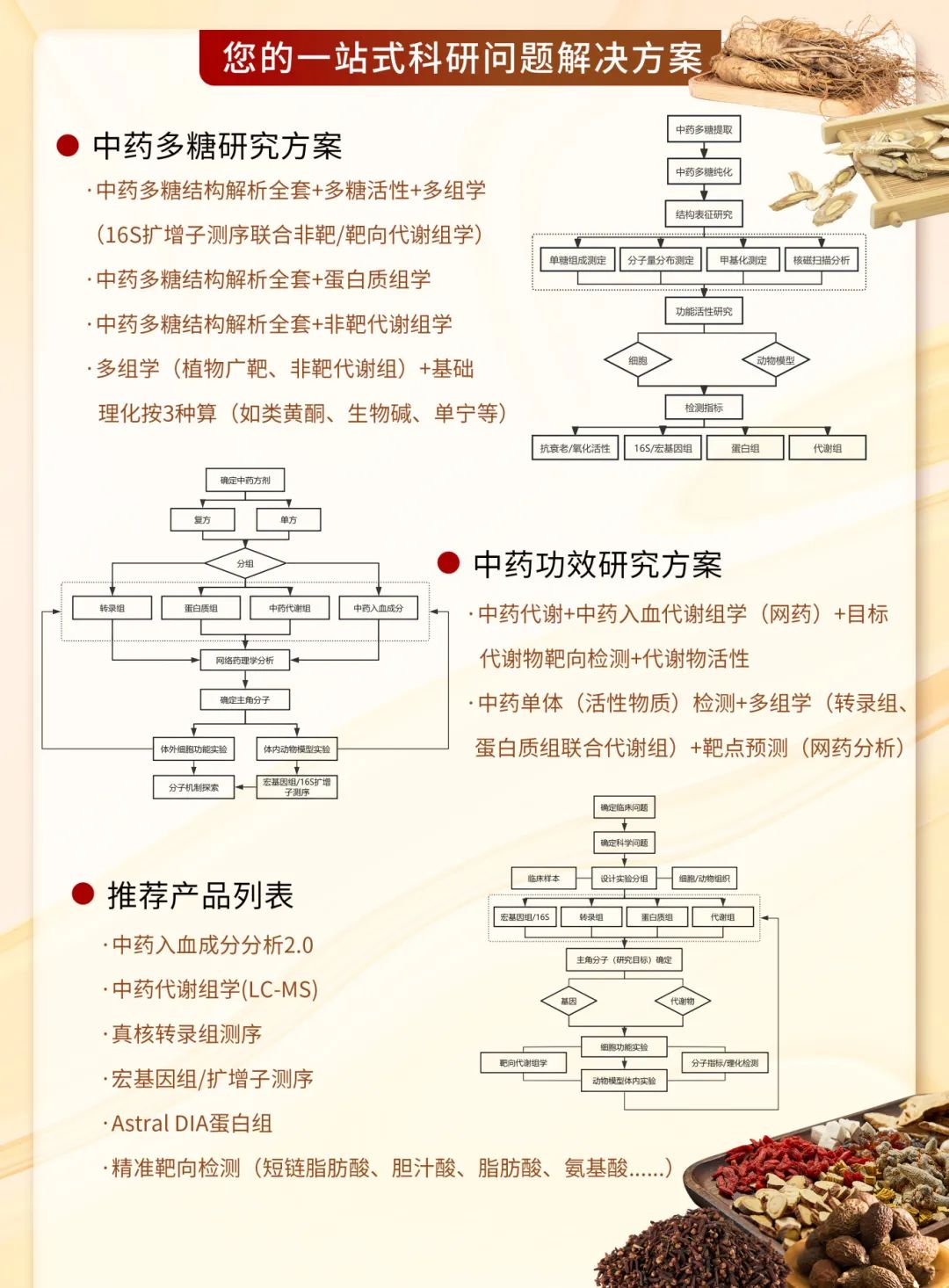
文献解读 | 网络药理能发IF 6.7?中药复方分析利器,深度挖掘治疗靶点

探究中药复方治疗疾病的物质基础,长期受到成分复杂、体内过程不清等难点的瓶颈限制。中药本身的活性成分、结构类似物、代谢产物、与体内成分结合的产物等物质往往在进入血液后方可产生药理作用。直接分析药材或制剂成分难以准确反应中药复方真正在体内起效的活性物质。

基于该研究特点,中药入血成分分析结合网络药理学的研究思路应运而生:通过筛选被机体吸收并存在于血液中的代谢物图谱,将研究焦点从“药材中有什么”转向“体内发挥作用的是什么”,为揭示中药复方在体内的直接作用物质提供了有力的验证依据。
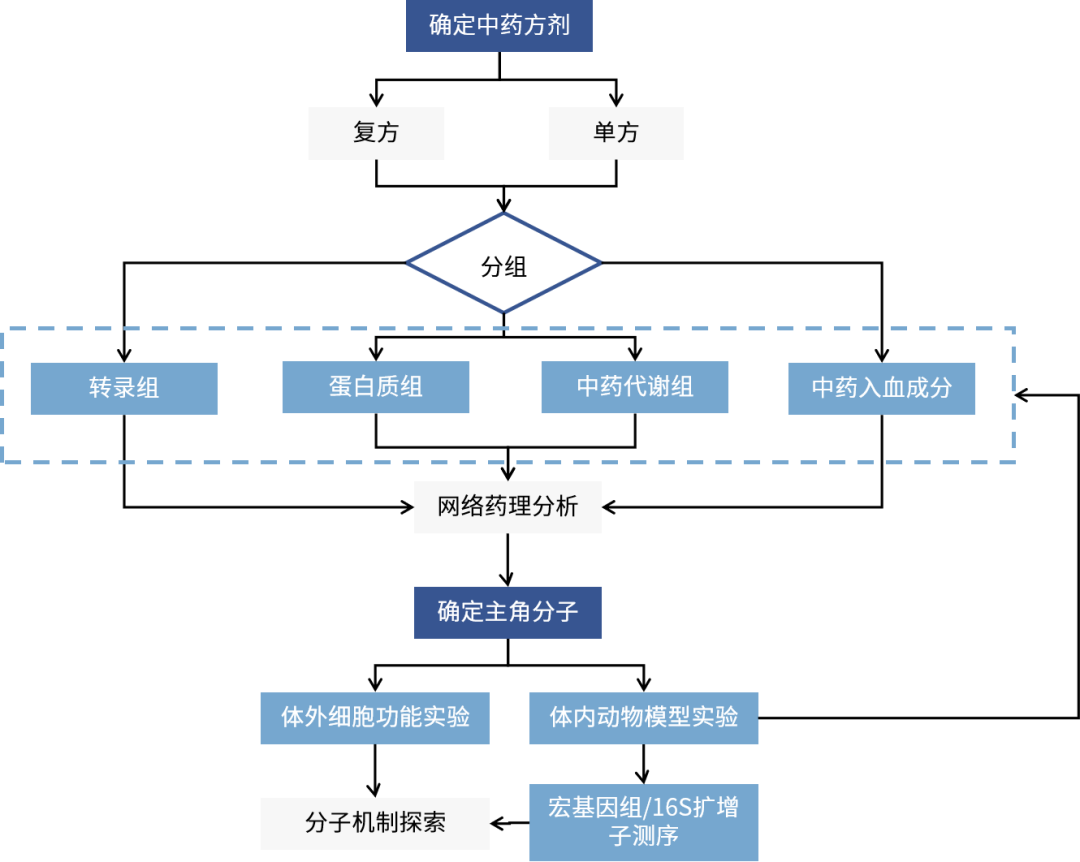
研究路线框架图
以中药入血成分分析为基础,结合网络药理学、多组学数据、动物模型验证等,能够进一步挖掘中药入血成分分析数据价值,结合疾病靶点数据库和生物通路知识,构建“成分-靶点-通路-疾病”的多维互作网络模型:一方面预测入血成分潜在的作用靶点和调控通路,为机制研究提供清晰的假说和优先方向;另一方面验证和阐释已知药效的表型背后复杂的分子网络调控基础。

阿霉素(DOX)是一种广泛使用的蒽环类化疗药物,对多种恶性肿瘤具有疗效。然而,其临床应用因剂量依赖性的心脏毒性而受到限制。苓桂术甘汤(LGZGD)是一种传统的中药方剂,已有研究显示其具有心脏保护作用,但其对 DOX 诱导的心脏毒性(DIC)的作用及机制尚未明确。
辽宁中医药大学李学涛教授团队于2025年2月在Phytomedicine (IF=6.7)杂志上发表了题为“Linggui Zhugan decoction ameliorating mitochondrial damage of doxorubicin-induced cardiotoxicity by modulating the AMPK-FOXO3a pathway targeting BTG2”的文章,该研究首次发现苓桂术甘汤通过靶向 BTG2 调控 AMPK-FOXO3a 信号通路,改善阿霉素诱导的心肌线粒体结构与功能损伤,为中药干预化疗性心脏毒性提供了全新的作用机制与治疗靶点。

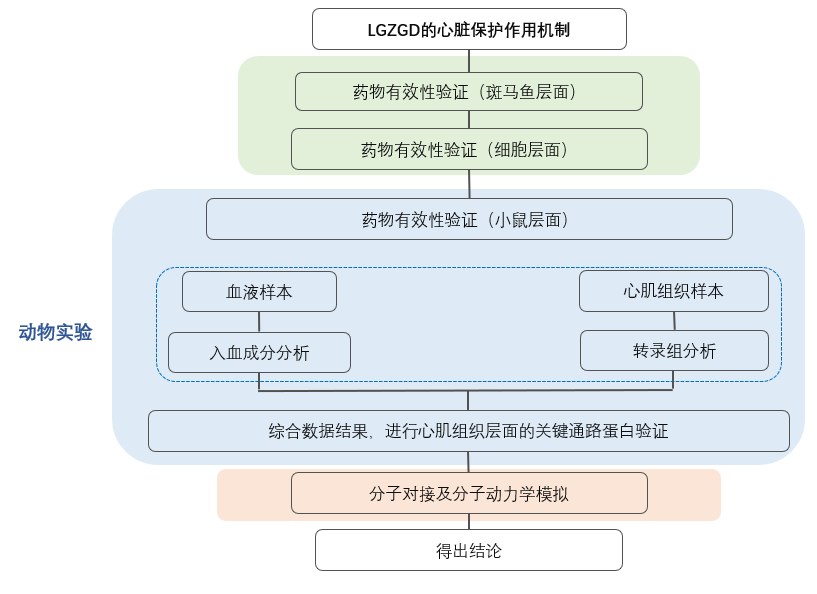
研究对象:斑马鱼及小鼠模型,体外心肌细胞
技术方法:入血成分分析,心脏组织转录组,网络药理学,分子对接,分子动力学模拟,组织切片研究,炎症因子检测,WB等
技术路线:
1.LGZGD改善了斑马鱼胚胎和成年斑马鱼的DIC
为评估LGZGD缓解DIC的疗效,使用斑马鱼胚胎构建模型。首先,通过将斑马鱼胚胎培养物暴露于含有DOX的E3溶液中(浓度分别为200、150、125、100、75、50和25 μM)48小时,确定了适当的DOX剂量。100-200 μM组的死亡率为100%,而75 μM组的死亡率为36.67%,并伴有心包水肿。相反,25-50 μM的DOX浓度未引起心包水肿。基于这些结果,选择75 μM DOX作为最佳建模剂量(fig S1)。
接下来,评估了LGZGD的暴露剂量。在20 mg/ml时,LGZGD导致胚胎30%的死亡率,而0-10 mg/ml的浓度未显示死亡率。因此,选择了2.5、5和10 mg/ml的浓度进行进一步研究(fig S2)。在受精后一天(1 dpf)的斑马鱼胚胎中,单独使用DOX或与不同浓度LGZGD联合进行处理(fig 1A)。DOX暴露导致心包水肿、心房变薄、变形为细长形状以及心室密集(fig 1B)。LGZGD治疗显著减轻了这些形态异常,减少了水肿,并恢复了正常的心脏结构(fig 1B)。DOX处理的胚胎心率略有下降,但LGZGD在所有测试浓度下逆转了这一效应(fig 1C)。暴露于DOX(包括75μM)的斑马鱼胚胎存活率明显降低,而LGZGD联合治疗显著提高了1、2和3 dpf时的存活率(fig 1D)。这些发现表明,LGZGD减轻了DOX诱导的斑马鱼胚胎形态和功能损伤,进一步缓解了DIC。
虽然斑马鱼胚胎可以提供一个快速的模型来研究急性DIC,但它们主要反映急性阶段的心脏毒性。因此,DIC的胚胎模型不能充分代表化疗几个疗程后甚至几年后肿瘤患者可能出现的迟发性心脏毒性。
为了评估LGZGD对慢性DIC的影响,采用了成年斑马鱼模型(fig 1E)。治疗从注射后28天开始。接受DOX处理的斑马鱼表现出显著的生长抑制,表现为体重减轻,而LGZGD缓解了这一现象(fig 1F)。组织学分析显示,DOX导致心肌纤维不规则、心肌收缩功能受损、心肌纤维丢失以及大量胶原沉积。LGZGD保留了心肌的完整性,改善了心肌收缩,并减少了胶原积累(fig 1G–I)。这些结果表明,LGZGD具有对抗成年斑马鱼中DOX诱导的慢性DIC的潜力。
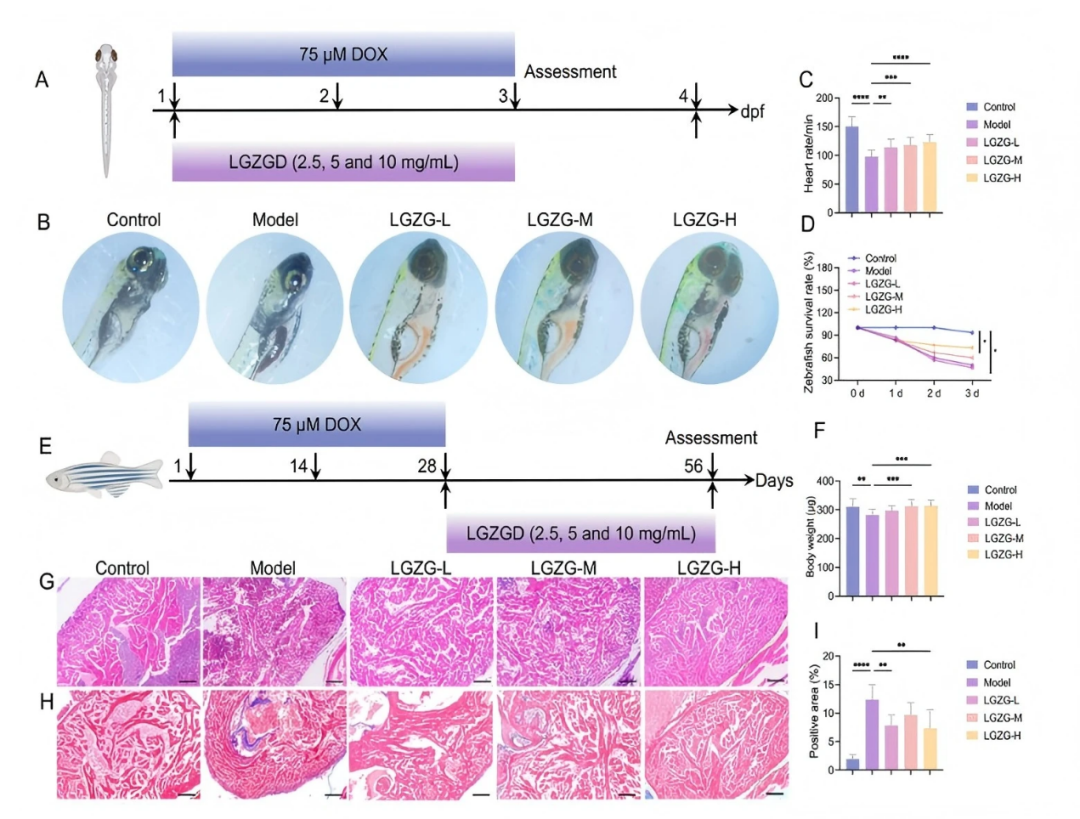
图1. LGZGD改善了斑马鱼胚胎和成年斑马鱼的DIC
2.LGZGD减轻了DOX诱导的心肌细胞坏死、凋亡、氧化应激和炎症
在体外实验中,为了确定DOX和LGZGD的最佳浓度,作者对心肌细胞存活率进行了评估。选择2μM DOX诱导心肌细胞(H9c2细胞)损伤。LGZGD (0~80 mg/ml)显著降低H9c2细胞的存活率,但在10 mg/ml时,存活率仍保持在90 %。因此,选择10 mg/ml作为LGZGD治疗的最大浓度。LGZGD部分恢复了经DOX处理的 H9c2 细胞的存活率和正常形态(fig 2C-D),并显著降低了 LDH、CK-MB、cTnI 和cTnT的水平(figS3),这表明LGZGD缓解了DOX诱导的细胞损伤。此外,LGZGD减少了PI阳性细胞的数量(fig2E),并抑制了DOX诱导的细胞凋亡(fig2F-G),表明LGZGD改善了H9c2细胞的坏死和凋亡。作者通过DCFH - DA探针和流式细胞术评估细胞内ROS水平,发现LGZGD显著降低细胞内ROS水平(fig2H-K)。另外,LGZGD在一定程度上提高了GSH和SOD活性,降低了MDA含量(figS4)。LGZGD显著抑制DOX处理的H9c2细胞中的促炎细胞因子的升高,包括IL-1β、IL-6和TNF-α(figS5)。这些结果综合表明LGZGD减轻了氧化应激、炎症和细胞凋亡,突出了其对抗DIC的治疗潜力。
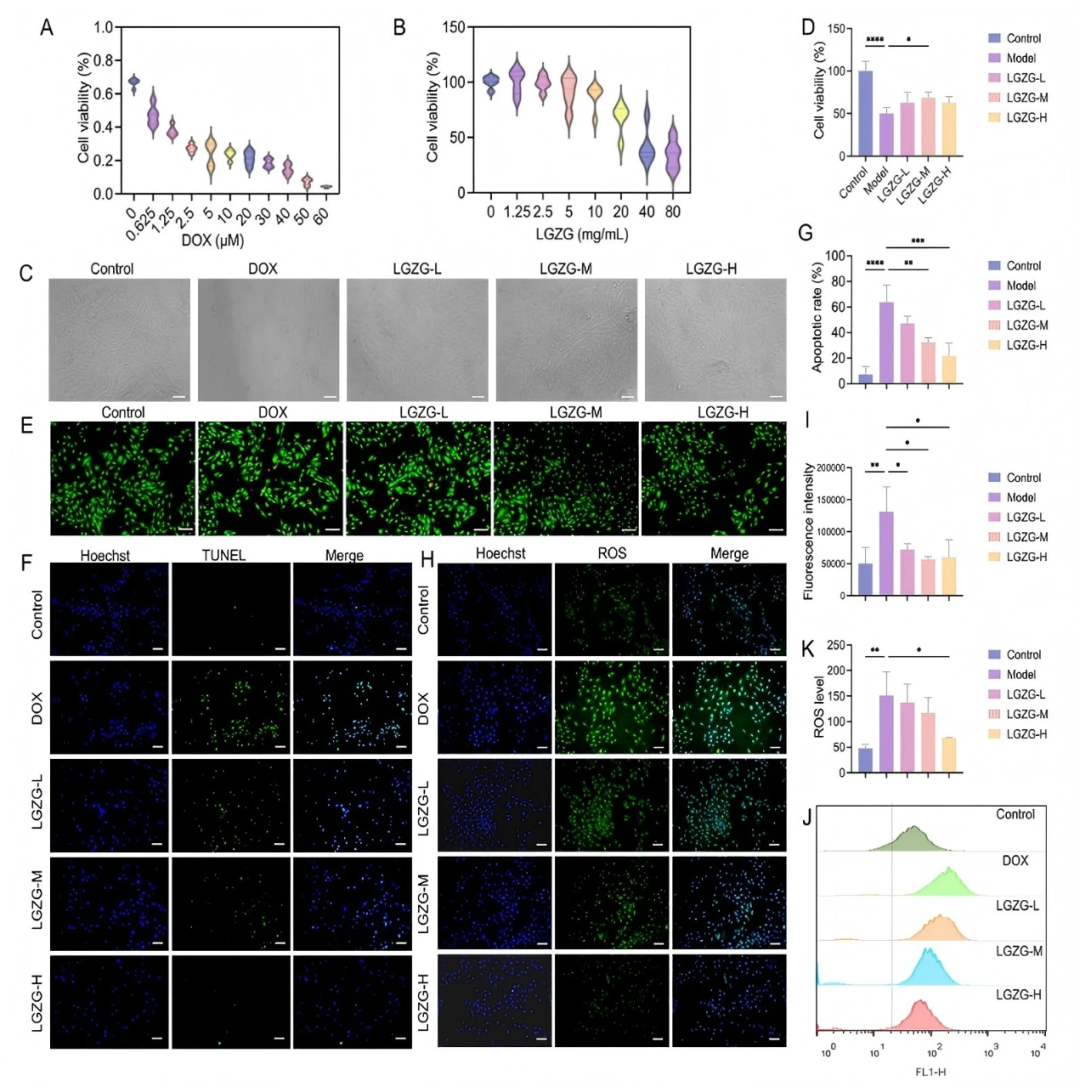
图2. LGZGD改善了DOX诱导的心肌细胞坏死,凋亡,氧化应激和炎症
3.LGZGD减轻了DOX诱导的H9c2细胞线粒体损伤
作者使用JC-1染色评估了LGZGD对线粒体膜电位(MMP)的影响。结果表明,与对照组相比,DOX处理的细胞显示出显著的MMP降低(fig 3A–D)。然而,不同浓度的LGZGD处理以剂量依赖性方式显著恢复了MMP(fig 3A–D)。为了评估线粒体形态,进行了Mito-Tracker Green染色。在对照组中,线粒体呈现出清晰的网格状结构,而DOX处理导致H9c2细胞线粒体充盈和异常分裂。不同浓度的LGZGD处理有效逆转了这些结构异常,减少了线粒体分裂并保留了网格状形态(fig 3E)。这些结果表明,LGZGD通过维持线粒体完整性和功能来保护免受DOX诱导的线粒体损伤。
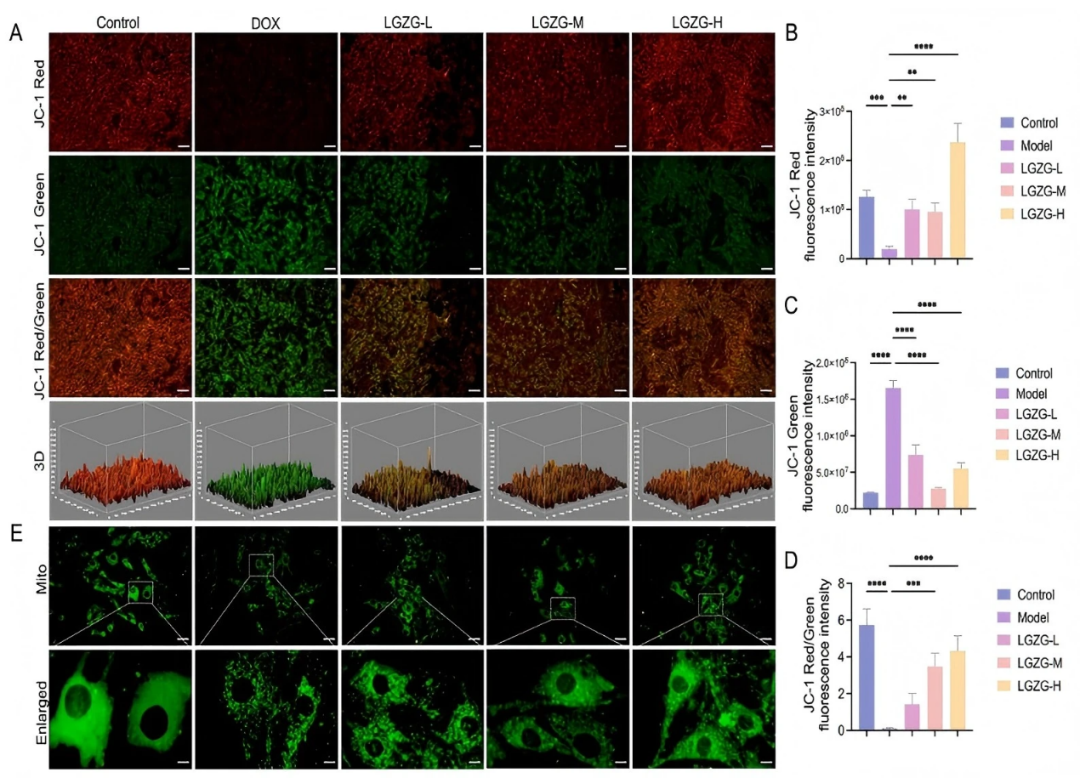
图3. LGZGD减弱了DOX诱导的H9C2细胞中的线粒体损伤
4.LGZGD缓解了DIC小鼠的心脏功能障碍
通过每 3 天腹腔注射 DOX 持续 3 周建立 DIC 小鼠模型,随后进行 30 天的 LGZGD 治疗(fig 4A)。与对照组相比,DOX 组小鼠心脏重量显著减轻,而 LGZGD 治疗显著增加心脏重量(fig 4B、C)。LGZGD 还以剂量依赖性方式逆转了 DOX 诱导的体重下降(fig 4D-I)。有趣的是,在各组之间未观察到心脏与体重比的显著变化(fig 4J)。超声心动图分析显示,DOX 治疗显著降低波形振幅并减弱壁运动(fig 4K、L)。定量测量表明,与对照组相比,DOX 组左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)显著降低,左心室收缩末期内径(LVIDs)显著增加(fig 4M-P)。相比之下,LGZGD 治疗可显著缓解心脏功能障碍,减少 DOX 引起的 LVEF、LVFS 下降及 LVIDs 增加(fig 4M-P),显示出对心脏功能的保护作用。
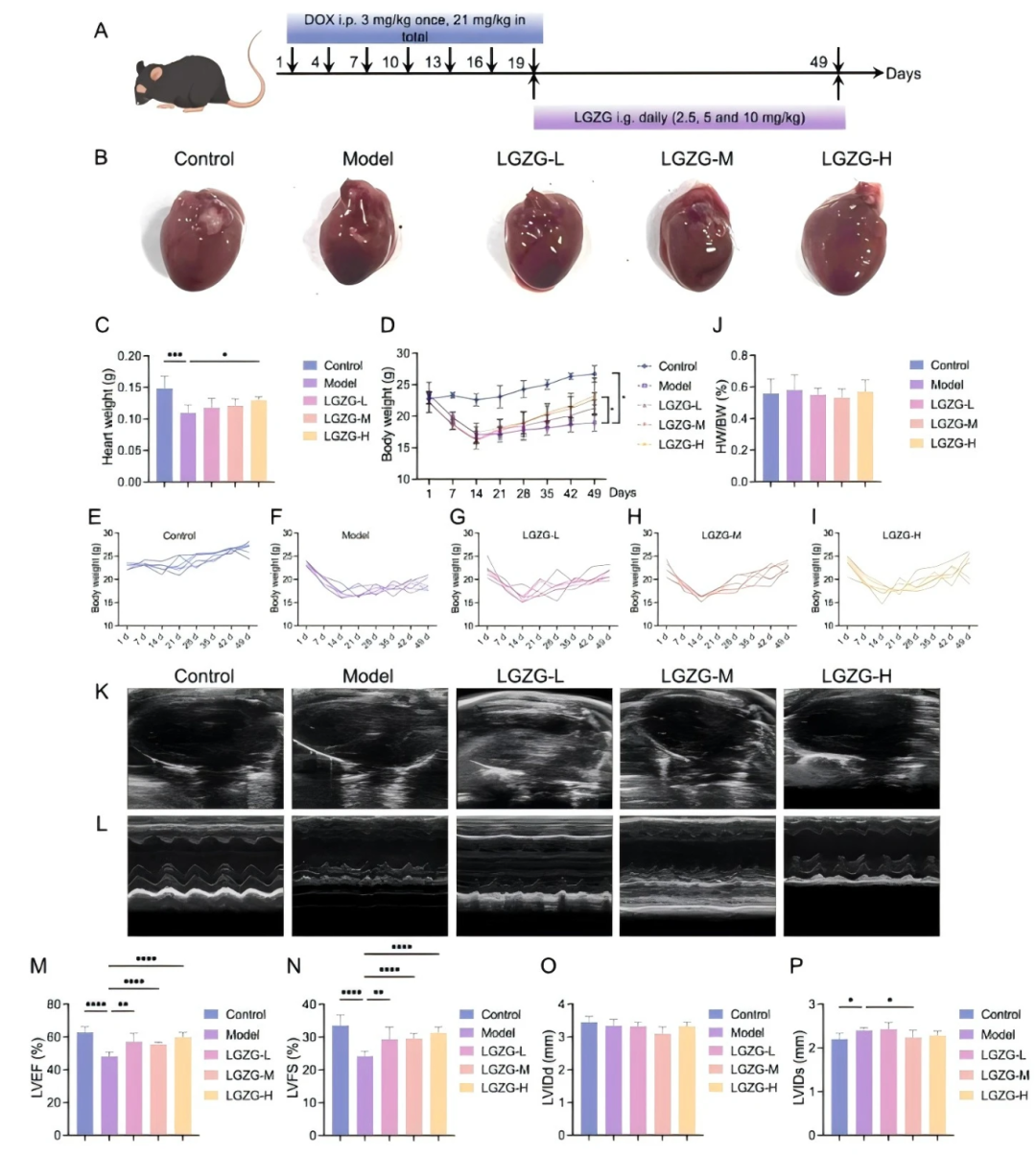
图4. LGZGD减轻了DIC小鼠的心脏功能障碍
5.LGZGD减轻了DIC小鼠的心脏损伤
心肌组织的组织病理学分析显示,DOX诱导的严重损伤,包括心肌细胞排列紊乱、心肌水肿、血管扩张、充血和炎性细胞浸润。LGZGD治疗显著减轻了这些影响,从而改善了心肌纤维组织,减少了炎症浸润(fig5A-B)。对照组小鼠心肌细胞排列整齐,细胞核集中于肌细胞内。相反,在DOX组中,心肌细胞表现出明显的结构紊乱,排列紊乱,心肌间质扩大。此外,还观察到炎症细胞浸润,心肌损伤评分显著升高。然而,使用 LGZGD 进行治疗可减轻这些病理变化。心肌细胞结构更加有序,炎性浸润明显减少,心肌损伤评分呈剂量依赖性降低。Masson染色(fig5C-D)和天狼星红染色(fig5E-F)显示DOX组有明显的心肌纤维化和胶原沉积。这些纤维化改变在LGZGD给药(fig5C-F)后明显减轻。此外,WGA染色显示DOX组心肌细胞明显小于对照组。LGZGD治疗有效地增加了心肌细胞的大小,使其恢复到正常尺寸(fig5G-H)。DOX处理的小鼠血清中LDH、CK - MB、cTnI和cTnT水平升高,LGZGD治疗后显著降低(figS6)。这些发现证实了LGZGD对DOX诱导的心肌损伤的实质性保护作用。
心肌细胞凋亡主要由氧化应激和炎症反应驱动,是心肌损伤的重要因素。为了进一步探索这一点,作者检测了不同处理后心脏组织中的氧化应激标志物、炎症介质和细胞凋亡。与对照组相比,DOX处理组小鼠GSH和SOD活性显著降低,MDA、IL-1β、IL-6和TNF-α水平显著升高。LGZGD 治疗则逆转了这些效应,显著提高了GSH和SOD的活性,同时显著降低了MDA、IL-1β、IL-6和TNF-α的水平(figS7-S8)。此外,基于超氧阴离子荧光探针二氢乙啶( DHE )的荧光,作者观察到DOX组心脏组织中ROS积累增加,表现为荧光强度增强。LGZGD治疗显著降低了心肌中的ROS水平,表明其抗氧化功效(fig5I-J)。TUNEL染色进一步揭示了DOX组中广泛的心肌细胞凋亡,LGZGD干预(fig5K-l)后显著减少了心肌细胞凋亡。总的来说,这些结果表明LGZGD有效地减轻了氧化损伤、炎症反应和细胞凋亡,从而保护心脏组织免受DOX诱导的损伤。
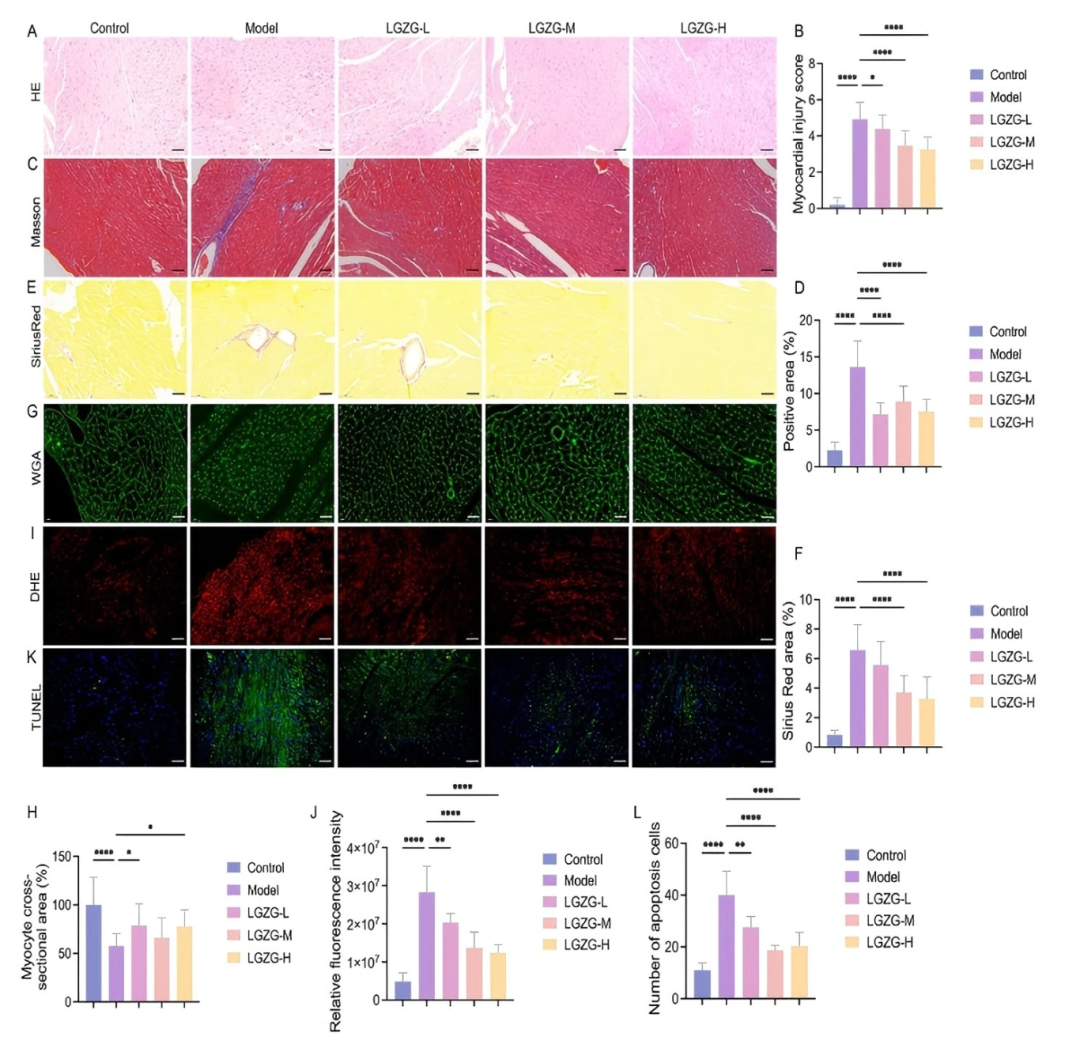
图5. LGZGD减轻DIC小鼠的心脏损伤
6.LGZGD逆转了DOX诱导的小鼠线粒体损伤
线粒体是ROS产生的主要场所,在细胞能量代中发挥核心作用。为了评估LGZGD对DOX诱导的线粒体损伤的影响,使用透射电子显微镜检查心脏组织的亚细胞结构。在DOX处理的小鼠中,心肌细胞显示出明显的线粒体异常,包括嵴断裂、皱缩、局灶性空泡化和线粒体密度的显著降低(fig6A)。LGZGD处理后线粒体形态接近正常,嵴结构恢复,空泡化减少,密度增加,表明LGZGD对DOX诱导的线粒体损伤具有保护作用。线粒体功能障碍常导致ATP生成障碍和Ca2+-ATP酶活性降低,最终导致能量代谢紊乱。在DOX组,心肌ATP水平和Ca2+-ATP酶活性显著降低,反映能量代谢受损。LGZGD处理恢复了这些水平,突出了其在改善线粒体功能和能量平衡中的作用(fig6B-C)。综上所述,LGZGD可有效改善DOX诱导的线粒体损伤,支持能量代谢恢复,并有助于维持心脏功能。
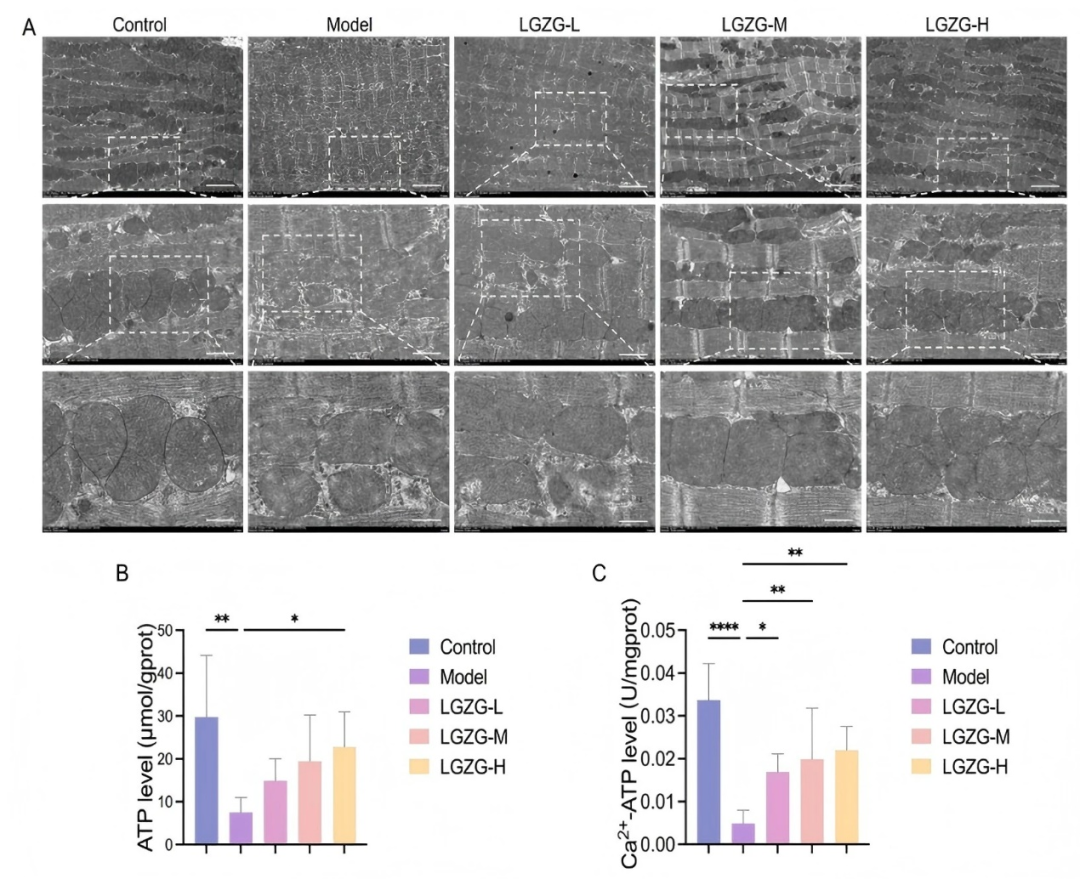
图6. LGZGD逆转了DOX诱导的小鼠线粒体损伤
7.LGZGD入血成分分析
为了阐明LGZGD治疗DIC的药效基础和分子机制,作者对其成分进行了全面分析。采用超高效液相色谱 - 四极杆 - 轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)鉴定LGZGD的组成(fig7A-D)。在LGZGD中总共鉴定到155个成分,其中37个成分为入血成分。这些成分可能作为LGZGD治疗DIC的活性成分。
为进一步探讨LGZGD的作用机制,作者采用网络药理学方法预测其潜在的治疗靶点。总共有512个靶点与LGZGD入血成分相关,167个靶点与DIC相关。其中,重叠靶点46个(fig7E)。利用Cytoscape软件,构建药物成分-靶点网络(fig7F)。预测具有显著治疗潜力的核心成分包括甘草素、3′-甲氧基光甘草定、光甘草定、16α-羟基脱氢曲美烯酸、glepidotin A、粗毛豚草素、粗毛甘草素A和粗毛甘草素B。将LGZGD和DIC的46个重叠靶点输入STRING数据库,生成PPI网络图。关键干预靶点主要包括AKT1、HIF1A、TNF、BCL2、PTGS2、HSP90AA1、EGFR、CASP3、ERBB2和STAT3(fig7G)。
GO功能富集分析表明 LGZGD 治疗 DIC 的潜在靶点主要富集于氧化应激反应、线粒体功能调控等生物过程及 ATP 结合等分子功能(fig7H)。KEGG富集分析结果表明LGZGD治疗DIC的靶点主要涉及癌症相关通路、HIF-1信号通路、FOXO信号通路、糖尿病并发症中的AGE-RAGE信号通路、PI3K-Akt信号通路、VEGF信号通路等(fig7I)。
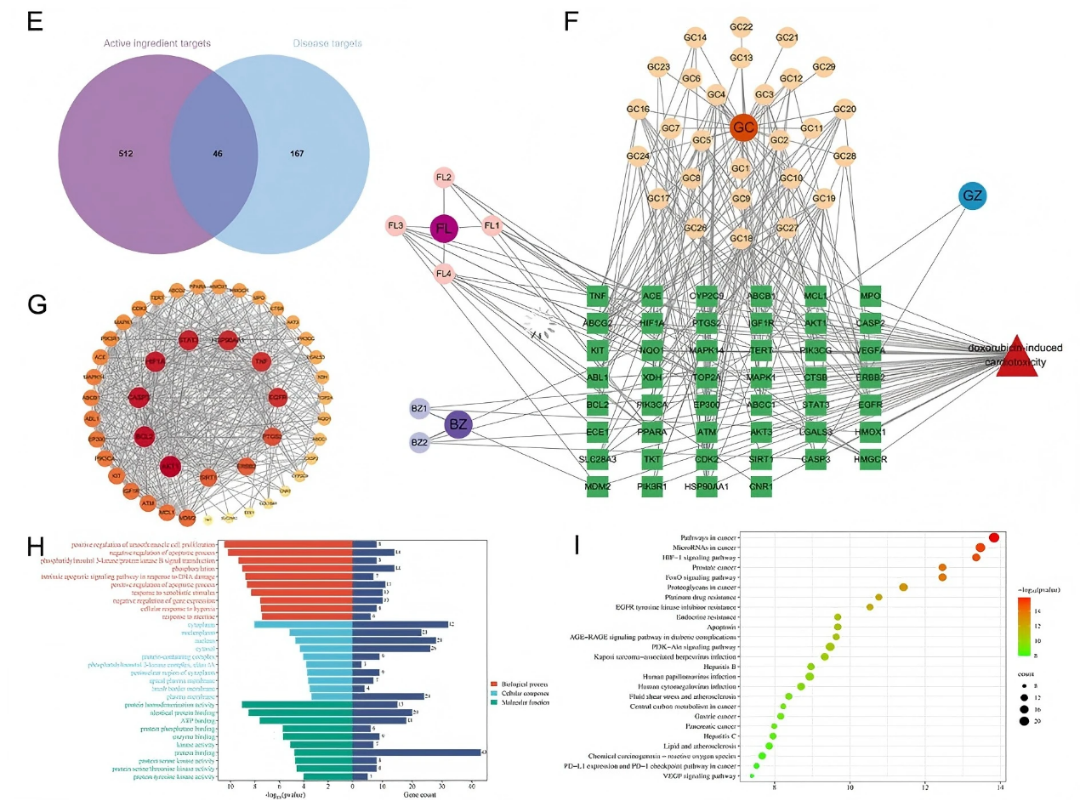
图7. LGZGD抗DIC的主要成分和网络药理靶点预测
| 三黍服务 | 技术参数 |
中药代谢组学 | |
中药入血成分分析 | |
真核转录组测序 | |
宏基因组测序 | |
更多服务,欢迎私信详询! | |
8.转录组学分析揭示了LGZGD治疗DIC的关键信号通路
作者采用转录组学研究LGZGD干预后心脏组织中的差异基因表达,阐明其治疗DIC的潜在机制,小提琴图表明样品的质量合格并适合用于后续分析(fig8A)。火山图表明,与对照组相比,模型组有105个差异基因:(53个上调基因和52个下调基因)(fig8B)。与模型组相比,LGZGD 治疗有29个基因发生变化(7个上调基因和22个下调基因)。这些显著差异基因的聚类结果以热图形式展示(fig8C)。GO分析显示,LGZGD相关的生物过程主要涉及行为反应、生物调节、细胞组织或生物发生和细胞组成(fig8D-E)。KEGG富集分析突出了LGZGD影响的通路,包括通过细胞色素P450的药物代谢,脂肪酸代谢,通过细胞色素P450的PPAR药物代谢,脂肪酸重编程,PPAR信号,AMPK信号和PI3K - Akt信号(fig8F-G)。
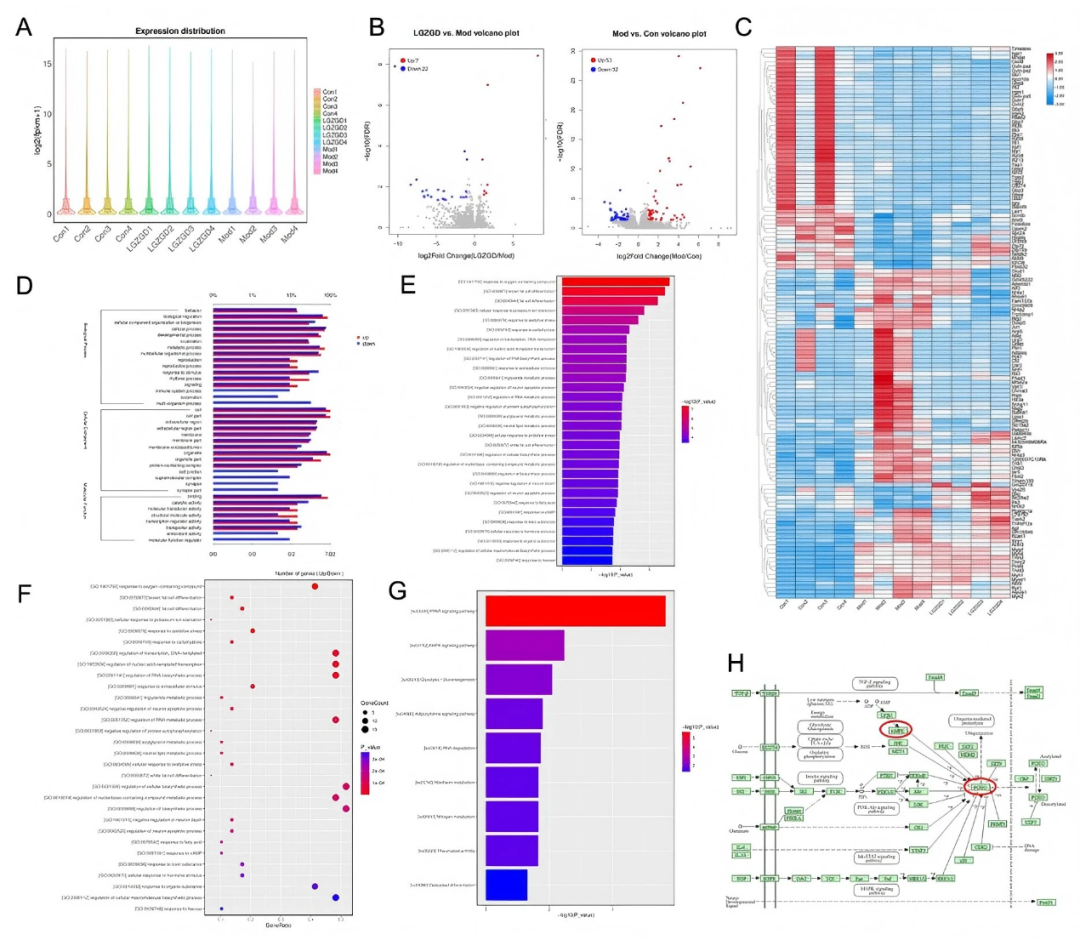
图8. 转录组学分析揭示了LGZGD治疗DIC的信号通路
9.LGZGD在体内调节BTG2和AMPK-FOXO3a信号通路的活性
基于网络药理学和转录组学,AMPK-FOXO3a信号通路成为LGZGD发挥治疗作用的关键机制。在鉴定的29个差异表达基因中,AMPK-FOXO3a信号通路中的关键调节因子BTG2在LGZGD处理后表达显著降低(figS9A)。为了验证这一发现,作者进行了RT-PCR检测。结果表明,在模型组中,BTG2 mRNA 的表达显著升高,而 AMPK和FOXO3a mRNA 的表达则显著降低。LGZGD处理逆转了这些趋势,显著降低了BTG2 mRNA,增加了AMPK和FOXO3a mRNA的表达(figS9B)。在蛋白水平,与对照组相比,模型组BTG2表达显著升高,而磷酸化AMPK (p-AMPK )与总AMPK的比值和磷酸化FOXO3a (p-FOXO3a )与总FOXO3a的比值显著降低。LGZGD处理逆转了这些效应,显著降低了BTG2蛋白表达,同时显著增加了p-AMPK / AMPK和p - FOXO3a / FOXO3a水平(fig9A–D)。这些发现表明LGZGD通过下调BTG2蛋白表达和增强AMPK - FOXO3a信号通路的激活来缓解DIC,从而减轻心肌损伤。
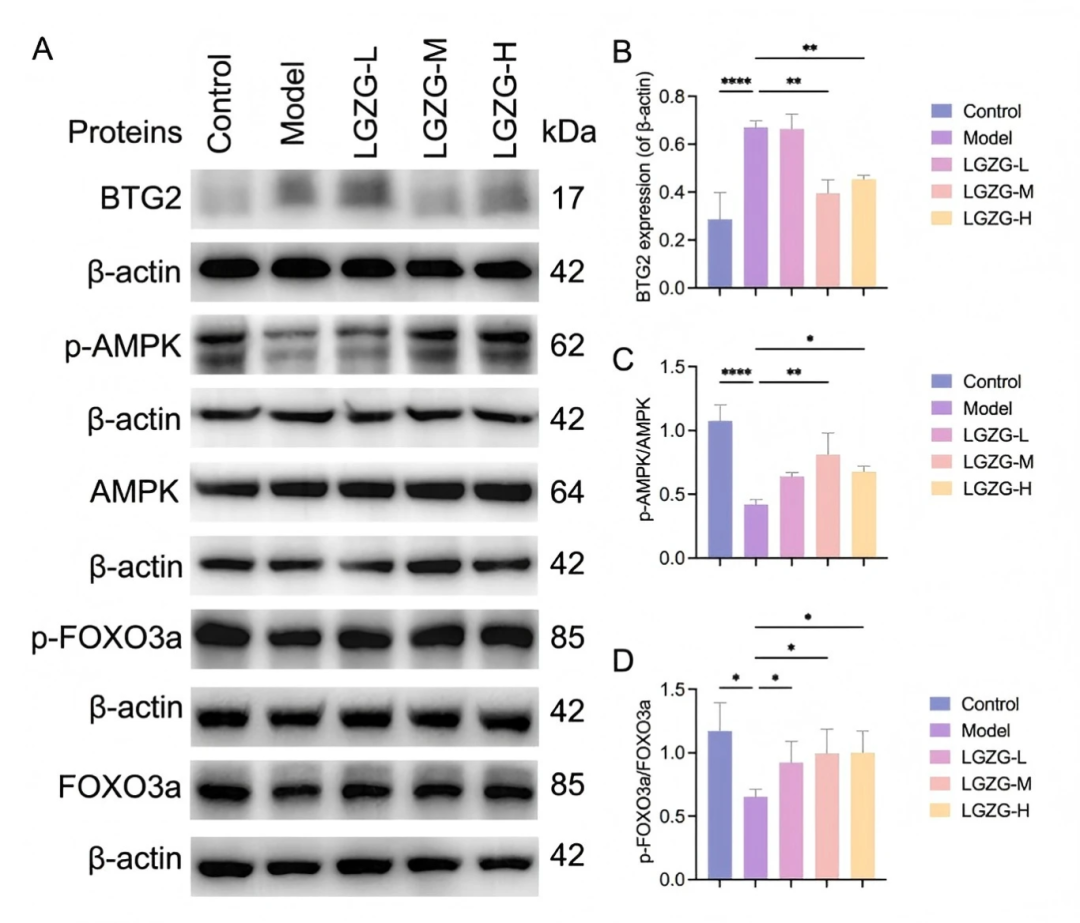
图9. LGZGD可以通过BTG2调节AMPK-FOXO3A途径来改善DIC
10.分子对接和MDs验证了LGZGD的靶点
AMPK是细胞能量稳态的关键调节因子,激活后可增强线粒体功能,从而发挥心肌保护作用。FOXO是FOXO转录因子家族的重要成员,也是AMPK的下游靶点,在线粒体动力学和自噬稳态中发挥关键作用。AMPK激活调节FOXO3a在Ser413位点的磷酸化,促进其核转位。该级联反应促进能量产生,恢复线粒体功能,减轻心肌损伤,其中FOXO3a是FOXO家族中研究最为广泛的成员。此外,转录组学分析显示,BTG / TOB家族成员BTG2的表达在LGZGD干预后的心脏组织中显著降低。高表达的BTG2可能通过抑制AMPK和FOXO3a活性,导致线粒体功能受损,加重心肌损伤,从而参与DIC病理过程。基于这些发现,LGZGD似乎通过调节BTG2靶向AMPK-FOXO3a途径发挥治疗作用。为了进一步探究LGZGD与BTG2之间的相互作用,作者进行了分子对接模拟。选取LGZGD中可能改善DI的8个核心成分,与BTG2进行分析。图10展示了BTG2与这些化合物之间的强相互作用,其特征是氢键,静电相互作用,疏水键和范德华力。这些化合物与BTG2的结合能均> 5 kcal/mol,表明具有显著的结合亲和力(fig10A-H)。其中,glyasperin A与BTG2的结合能最低(fig10I)。
分子对接和动力学模拟结果显示,LGZGD的核心成分与BTG2有较强的结合亲和力(图7A-I),且模拟的复合物结构稳定(图7J-M),进一步证实了LGZGD通过BTG2发挥治疗作用的分子机制。
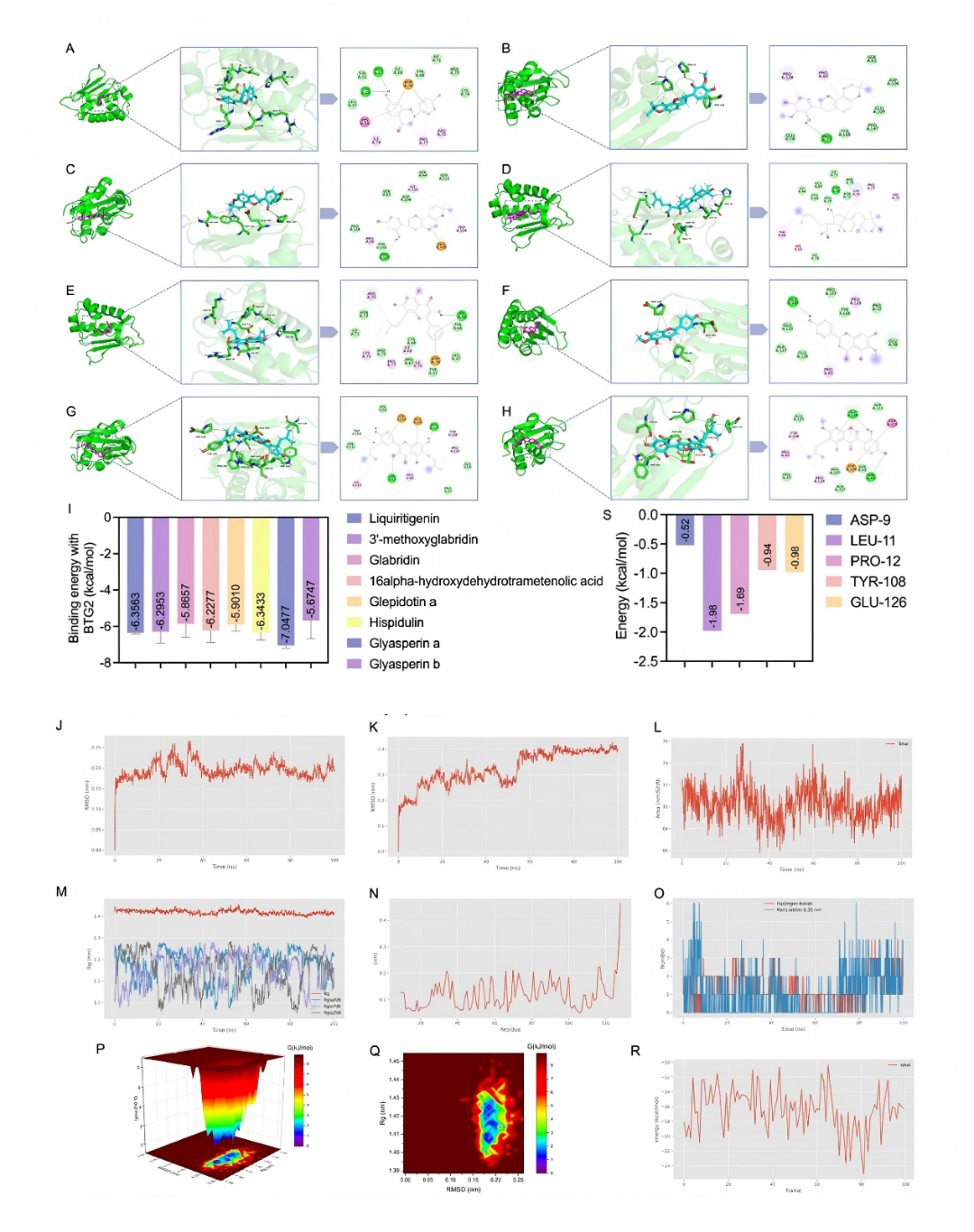
图10. 分子对接和MDs验证了LGZGD的靶标
本研究表明苓桂术甘汤通过靶向 BTG2 调节 AMPK-FOXO3a 通路,减轻氧化应激、炎症和细胞凋亡,保护线粒体结构与功能,从而显著改善阿霉素诱导的心脏毒性。
滑动查看更多:
排版:野凌
审核:三黍生物企宣部