文献解读
文献解读|岩藻糖胶在胃肠道中的链构象、黏附特性及其对肠道菌群的影响

岩藻多糖(Fucoidan, FUC)是一种重要的海洋多糖,普遍存在于褐藻和棘皮动物中,它具有多种生物活性,包括抗菌、抗病毒和胃粘膜保护活性。近年来,人们越来越关注其物理化学性质,使其成为一种有前景的食品输送系统功能材料,如乳剂和水凝胶。多糖的生物活性和理化性质与其一级结构、分子量大小和链构象有关。了解粘蛋白-多糖的相互作用及其机制对于设计具有定制特性的多糖传递系统至关重要。在肠道中,不可消化的多糖可以被肠道菌群利用,调节肠道菌群组成和代谢物的产生,进而影响免疫系统,防止病原体附着在肠表面,保护肠上皮屏障。
2023年1月南京工业大学食品与轻工学院在Carbohydrate Polymers(IF=10.723)杂志上发表题为”Chain conformation, mucoadhesive properties of fucoidan in the gastrointestinal tract and its effects on the gut microbiota “的研究论文。笔者通过消化模型模拟评估了Ta-FUC在GIT(胃肠道)中的结构特征及其对肠道细菌的影响。通过流变学和扫描电子显微镜研究了Ta-FUC的黏液粘附能力及其分子间作用力。本文提供了有关FUC生物可及性的有效信息,并揭示其作为靶向结肠输送系统的益生元或辅料的潜力。


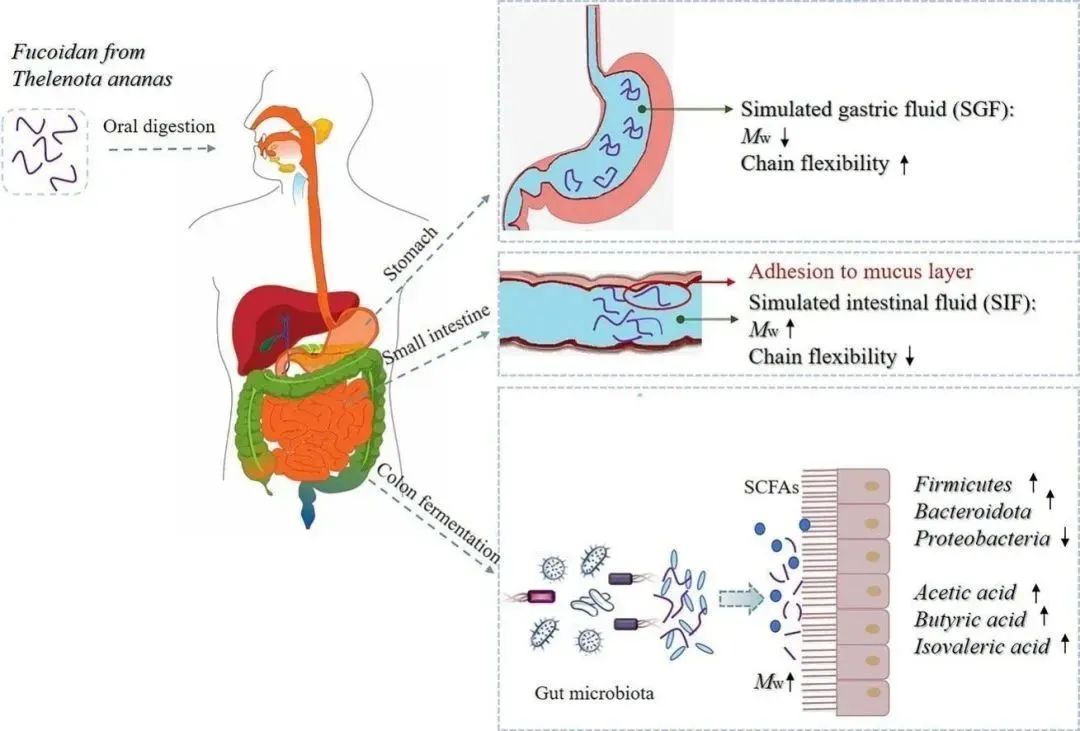
通过INFOGEST模型来模拟消化以及多糖结构的变化。从图1来看,唾液和酶不影响甘露半乳聚糖等的结构,但是经胃消化后分子量开始降低,并随着时间的推移开始表现出轻微的差异。同时,Ta-FUC在肠液中的保留时间比在胃液中的保留时间短,表明这些变化可能与溶液中容易形成多糖团聚体有关。其次,唾液以及肠液中的Ta-FUC多以随机线团的形式存在,而胃液中的Ta-FUC采用了更灵活的线圈构象,链的卷曲和弯曲程度更高(图2)。
聚合体的破坏和多糖链中化学键的断裂都会导致CR(还原性糖)的增加。从表1可以看出,CR值在唾液消化期间保持稳定,在胃消化和肠消化开始阶段略有上升。唾液消化过程中游离单糖含量无明显变化。在这一过程中,没有释放游离灶,说明FUC的主要结构保持完整。结合消化过程中游离单糖含量和CR的结果,笔者发现分子量的变化是由聚集物和链构象的破坏引起的,而不是糖苷键的断裂。
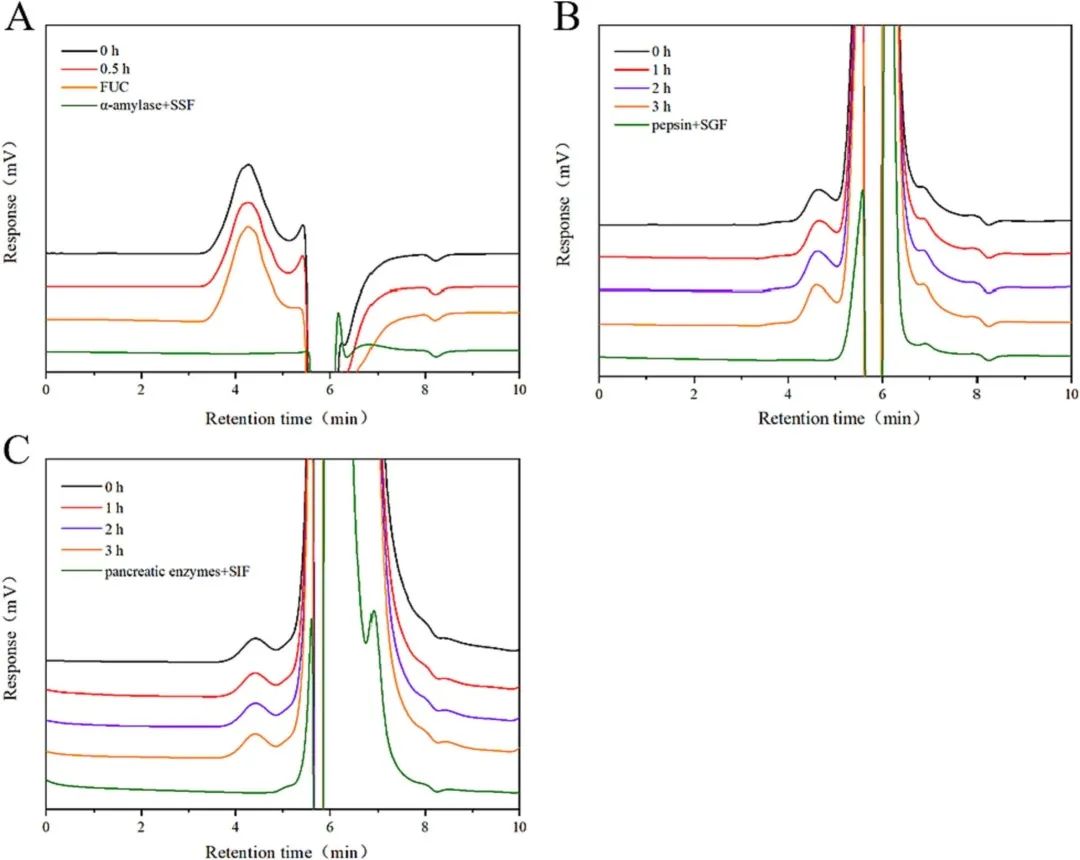
图1 FUC的分子量色谱图(A)模拟唾液消化,(B)模拟胃消化,(C)模拟小肠消化。
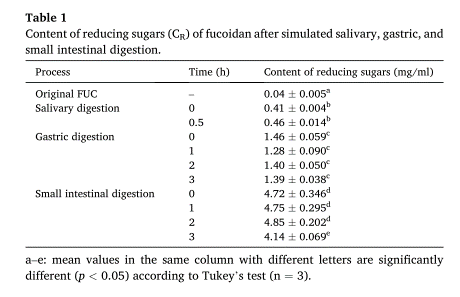
表1. 模拟唾液、胃和小肠消化后岩藻糖苷还原糖(CR)的含量
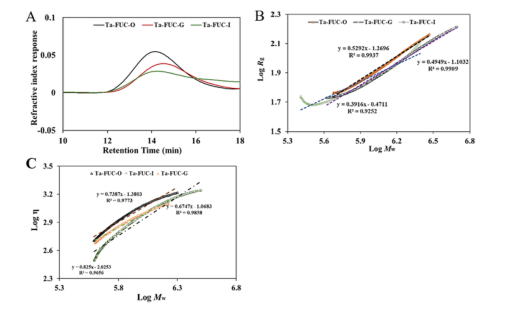
图2. 模拟消化过程中Ta-FUC的链构象
2.1发酵后Ta-FUC特性的变化及肠道菌群组成
在体外发酵过程中,总碳水化合物、游离单糖以及分子量均为0-24 h显著下降,48 h后逐步上升。这些结果表明,菌群在24 h内主要集中在增殖,然后开始分解和利用多糖。
16s结果表明样本量合理,物种丰度和多样性较高。发酵48 h后,FUC处理组的群落丰富度和多样性均高于对照组和模型组,这个结果与化学成分分析一致。通过组间PCA以及热图分析可知,各组间物种丰度相近,且多样性差异在OTU水平上。发酵后,各组的优势菌均为拟杆菌门、厚壁菌门和变形菌门。在肠道生态系统中,当基因组中的多糖利用位点被激活时,一些拟杆菌可以促进自身多糖降解酶的分泌,从而切断特定的糖苷键,降解多种多糖(图3)。此外,在发酵后的FUC存在下,健康小鼠和高脂血症小鼠肠道菌群中变形菌门的比例均大幅下降。这些结果表明,FUC可以通过调节肠道菌群的组成和结构来促进肠道健康,预防疾病。
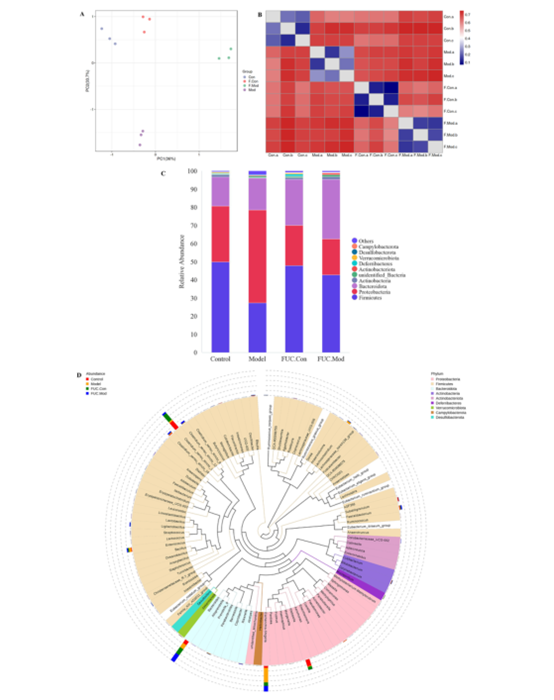
图3. (A) OTU级别的主成分分析。(B) OTU级别的非度量多维尺度。(C)门水平的相对丰度。(D)属水平的肠道微生物组成。
2.2Ta-FUC体外消化对SCFAs的影响
SCFAs浓度被认为是微生物活动的重要指标,主要受饮食习惯和宿主肠道共生菌群结构的影响。体外发酵后SCFAs结果表明,FUC可以促进健康小鼠和高脂血症小鼠肠道菌群的代谢和发酵。(表4)
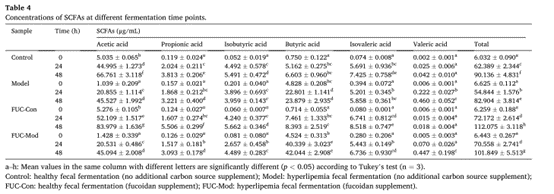
表4. 不同发酵时间点的SCFAs浓度。
3.1流变特性
笔者基于二元混合物的流变学,利用连续流动和动态振荡流变学,评价了MUC(黏蛋白)和FUC之间的相互作用。根据图4所示的定性分析发现FUC比MUC更不紧凑和稳定,受流动行为和时间的影响更小。随着剪切速率的增加,溶液的粘度降低,这可能是由于聚合物链逐渐与流动方向解缠或排列,聚合物链网丢失导致。
加入n -乙基马来酰亚胺(NEM)、尿素(U)和TW20形成含有阻断剂的聚合物分散体,用来深入了解FUC以及MUC在粘附过程中的超分子相互作用。结果表明PH=7时,添加了0剪切速率的阻断剂后,MUC-FUC-NEM的粘度显著降低,而且所有聚合物溶液的剪切应力均有下降,以上结果反映了聚合物分子间松散的纠缠的不同,表明在模拟肠道环境中,MUC和FUC之间存在复杂的相互作用。
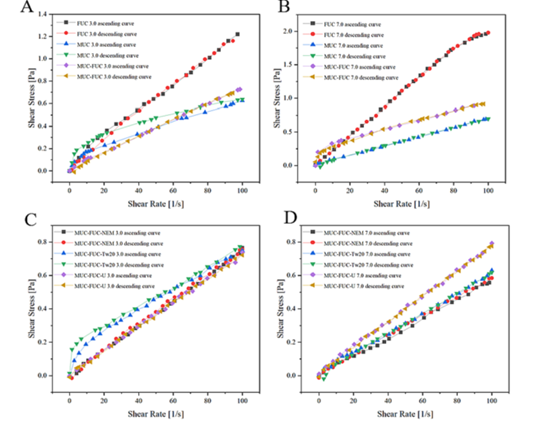
图4. 聚合物分散体(FUC, MUC和MUC-FUC) (A, B)和MUC-FUC阻滞剂(NEM, Tween 20和尿素)(C, D)在pH=3和pH=7时的流动曲线。
3.2扫描电镜形态观察
电镜结果发现,酸性条件下(模拟胃环境),FUC及MUC均为片状而MUC-FUC混合物表现出多孔结构。说明酸性环境下FUC与MUC相互作用有限,这与流变学分析结果一致。中性条件时,多糖的表观形态由片状逐渐变为多孔,形成疏松的网状结构。这可能是由于较高的负电荷密度导致链之间的距离较远,从而促进了结构的可扩展性和亲水性。此外,在肠道环境中观察到MUC-FUC存在三维纠缠和相互连接的网络,表明MUC与FUC之间存在有效的相互作用。

本研究在体外研究了Ta-FUC在消化和粪便发酵过程中的结构特征及其与黏蛋白的相互作用。通过对其分子量、CR、单糖组成和链构象参数的分析,估计Ta-FUC是一种不可消化的多糖。然而,多糖链在模拟胃条件下转向更卷曲和弯曲,Mw暂时下降但主要结构保持稳定。体外粪便发酵48 h后,Ta-FUC的Mw显著降低,SCFAs含量随时间增加。根据菌群组成分析,Ta-FUC可以被肠道菌群利用,也可以被微生物产生的水解酶降解。
此外,通过流变学分析和扫描电镜研究了Ta-FUC的粘蛋白粘附性能。Ta-FUC在肠道环境中比在胃环境中表现出更高的粘附功能。超分子间的主要相互作用按强度排序为二硫键、氢键和疏水相互作用。延长FUC在肠黏膜的滞留时间,构建三维网络,有助于提高MUC对功能性成分在肠道黏膜传递的屏障性能。目前的研究为FUC作为益生元候选材料和靶向给药材料在功能性食品和制药行业的潜在应用提供了重要的结构和功能信息。

往期推荐
客户文章|Food&Function:生态环境对苜蓿多糖结构特性和生物活性的影响
Front Nutr 一作解读|添加天竺葵精油的木薯淀粉复合膜相关性能的研究
一作解读|Foods 火参果 (Cucumis metuliferus) 果皮中果胶的免疫活性和肠道微生物群调节
客户文章|Frontiers in Nutrition.一作解读:甘油和赤藓糖醇不同配比对玉米淀粉基薄膜性能的影响
客户文章|F.C.一作解读:微波加热制备淀粉-脂质复合物的研究
... ...

文本:宗娴
排版:檀檀
审核:三黍市场运营部



