糖尿病 肠道菌群 代谢组学 代谢物 肠道微生物 宏基因组 血浆代谢组 队列研究 Nature Medicine
Nat Med.(IF=50)| 复旦大学新发布糖尿病队列研究,临床表型与代谢数据关联文章思路有了!

2型糖尿病(T2D)作为一种复杂的代谢性疾病,其发病机制涉及遗传、环境及肠道微生物组的共同作用。近年研究表明,肠道菌群通过代谢产物(如短链脂肪酸、胆汁酸等)参与宿主的能量代谢、炎症调节与胰岛素敏感性调控,成为代谢性疾病研究的热点。已有大量证据表明,肠道菌群通过其代谢产物深度参与宿主的能量代谢、炎症调节与胰岛素敏感性控制。然而,糖尿病及其前期状态(如空腹血糖受损、糖耐量受损)存在显著的生物学异质性,尚缺乏系统性研究整合菌群、代谢物与生活方式干预之间的动态关联。
2025年4月8日发表于Nature Medicine的研究(标题:Microbiome–metabolome dynamics associated with impaired glucose control and responses to lifestyle changes)中,研究团队通过两个瑞典人群队列,结合宏基因组、血浆代谢组和饮食数据,系统探索了糖代谢受损过程中肠道菌群-代谢物轴的变化特征,并进一步评估了短期生活方式干预(饮食、运动)对代谢网络的调节作用。研究团队发现,饮食与运动干预对糖尿病相关代谢物呈现差异化调节模式:既有共通又有不同之处,但协同作用明显—可共同逆转约65.9%的异常代谢物。因此,最有效的代谢疾病防治方案需要饮食、运动、甚至是药物或益生菌等多维度干预的协同配合。

两个独立的瑞典人群队列,包括发现队列(IGT cohort,n= 697)与验证队列(SCAPIS cohort,n=470)。
发现队列(IGT队列,n=697):涵盖五类糖代谢状态人群,包括正常糖耐量(NGT,n=220)、单纯空腹血糖受损(IFG,n=185)、单纯糖耐量受损(IGT,n=173)、混合型糖耐量异常(CGI,n=74)及未治疗的T2D患者(n=45)。
验证队列(SCAPIS队列,n=470):独立人群验证,包括NGT(n=201)、IGT(n=130)、CGI(n=84)及T2D(n=55),通过BMI匹配减少肥胖混杂影响。
临床表型:34项生化指标(空腹血糖、HbA1c、HOMA-IR等)+ FINDRISC糖尿病风险评分;
饮食结构:过MiniMeal-Q问卷采集193项膳食变量,量化营养素摄入;
肠道微生物组:宏基因组测序;
血浆代谢组:非靶向代谢组学。
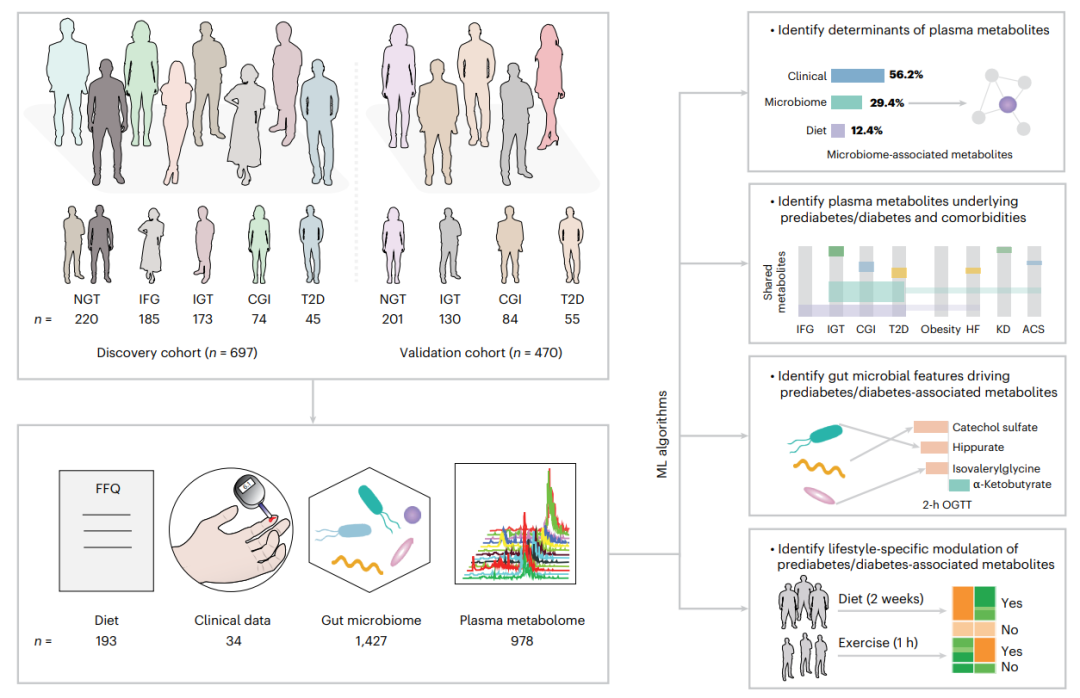
图1. 主要研究思路及分析策略
对从糖尿病前期、初治 T2D 和对照个体 (50-64 岁) 收集的血浆样本进行代谢组学分析,这些个体被纳入瑞典葡萄糖耐量受损 (IGT) (n = 697) 和瑞典 CArdioPulmonary bioImage Study (SCAPIS) (n = 470) 队列25,分别用作发现和验证队列。在发现队列中,220 例为 NGT(正常葡萄糖耐量),185 例为孤立性空腹血糖受损 (IFG),173 例为孤立性 IGT,74 例为混合葡萄糖不耐受 (CGI),45 例为基于空腹血糖水平或口服葡萄糖耐量试验 (OGTT) 筛查检测到的 T2D。
并使用梯度提升决策树 (GBDT) 算法评估了临床表型、微生物组和饮食在瑞典队列的相对预测能力(扩展数据图2)。
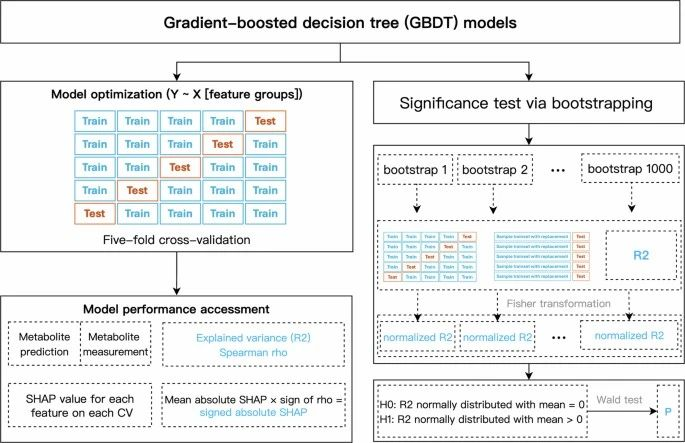
图2. 使用 GBDT 模型对临床、微生物组和饮食特征组的代谢物预测程序的流程图(扩展数据)
研究发现,潜在的决定因素在糖尿病前期和 T2D 中持续存在,仅肠道微生物组就占血液代谢物差异的近三分之一—是在健康个体中测得的两倍。
研究通过五种策略系统评估并验证了197种与肠道菌群显著相关的血浆代谢物(图3a)。分析显示,无论采用Canopy、Kraken 2还是MetaPhlAn 4等不同宏基因组注释方法,或使用GBDT与随机森林等机器学习模型,代谢物预测结果高度一致(R均 >0.95,P均 <2.2×10⁻¹⁶)。在不同人群中,瑞典队列的结果亦成功复制于以色列和英国TwinsUK队列(图3c),显示菌群-代谢物关联的广泛适用性。
跨人群差异分析中,15种代谢物在以色列与瑞典队列中预测能力不一致,主要涉及苯甲酸与黄嘌呤(咖啡因)代谢物,如5-乙酰氨基-6-氨基-3-甲基尿嘧啶等(图3c)。进一步分析发现,与咖啡代谢密切相关的菌属Lawsonibacter asaccharolyticus在瑞典人群中丰度显著更高,并与咖啡摄入频率正相关(图3d)。
对无菌(GF)与常规饲养(CONV-R)小鼠门静脉的血浆进行了代谢组学分析,并确定了在人类中发现的 197 种微生物组相关代谢物中的 66 种,其中超过一半 (54.5%) 显示出两种模型之间的显著差异(图 3e)。
此外,菌群α多样性(Shannon指数)可解释49.4%的血浆代谢组变异,远高于临床指标(9.4%)(图3f)。脂质类与氨基酸代谢物分别解释39.8%与35.1%的差异,但合并后仅解释43.5%,提示两者可能通过共同菌群机制交叉调控,进一步拓展了对菌群-代谢网络的理解(图3)。
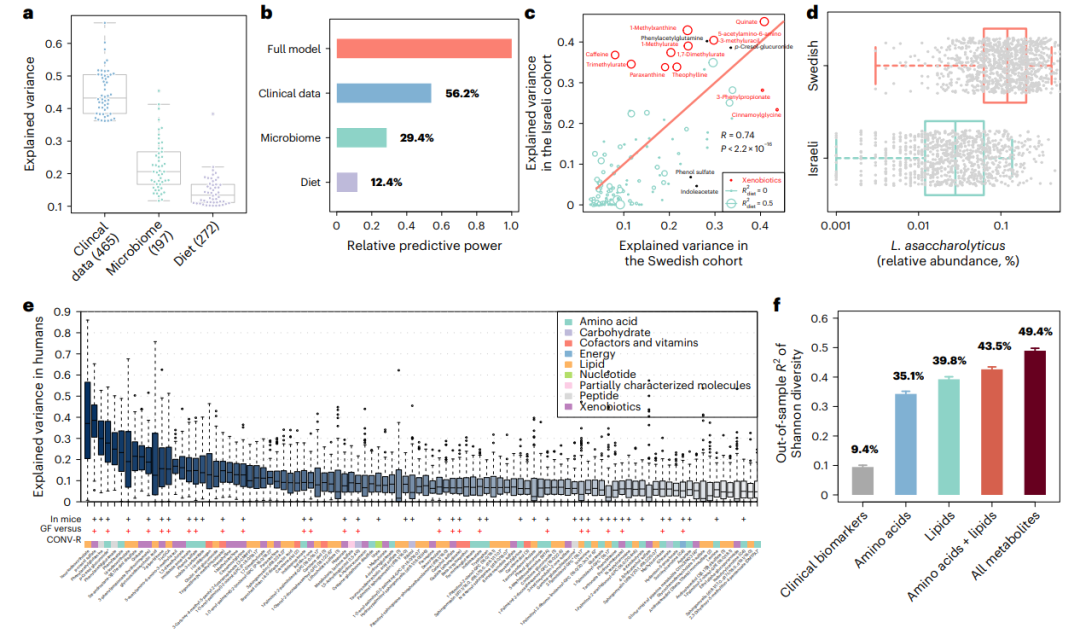
图3. 微生物组相关代谢物的稳健预测
研究团队在瑞典发现与验证队列中共识别出502种与糖调节异常显著相关的血浆代谢物,涵盖IFG、IGT、CGI与T2D等状态(图4a)。其中54.2%为脂质代谢产物,20.3%为氨基酸代谢相关。多数代谢物与糖代谢状态呈显著相关性,调整年龄与性别后,469种代谢物仍与糖耐量异常的发生风险正相关或负相关(图4b)。此外,56种IFG相关代谢物在其他所有糖代谢异常状态中也同步变化,提示IFG与IGT间的分子机制重叠显著(图4c)。
进一步对比显示,502种代谢物中有117种与超重/肥胖状态相关,仅8种为肥胖特异(如马洛酸、肌醇等)(图4c)。IFG组中肥胖相关代谢物占比最高(58.9%),显著高于IGT、CGI或T2D组(图4d)。此外,这些代谢物中有245种也与EPIC-Norfolk队列中非传染性疾病(如T2D、心衰、肾病)相关,另有205种与ACS患者高度重叠,反映其在心代谢疾病中的广泛代表性(图4c)。
在502种代谢物中,有143种与肠道菌群相关(图4e)。以CGI和T2D为目标,研究构建基于代谢物、微生物组和FINDRISC评分的分类模型,发现在验证队列中,仅非葡萄糖代谢物模型AUC达0.83,优于微生物组(MGSs)与FINDRISC模型(图4f)。以143个菌群相关代谢物构建的模型在不同人群中亦具有良好区分力(AUC=0.79),进一步验证了其作为早期代谢异常生物标志物的潜力(图4g)。
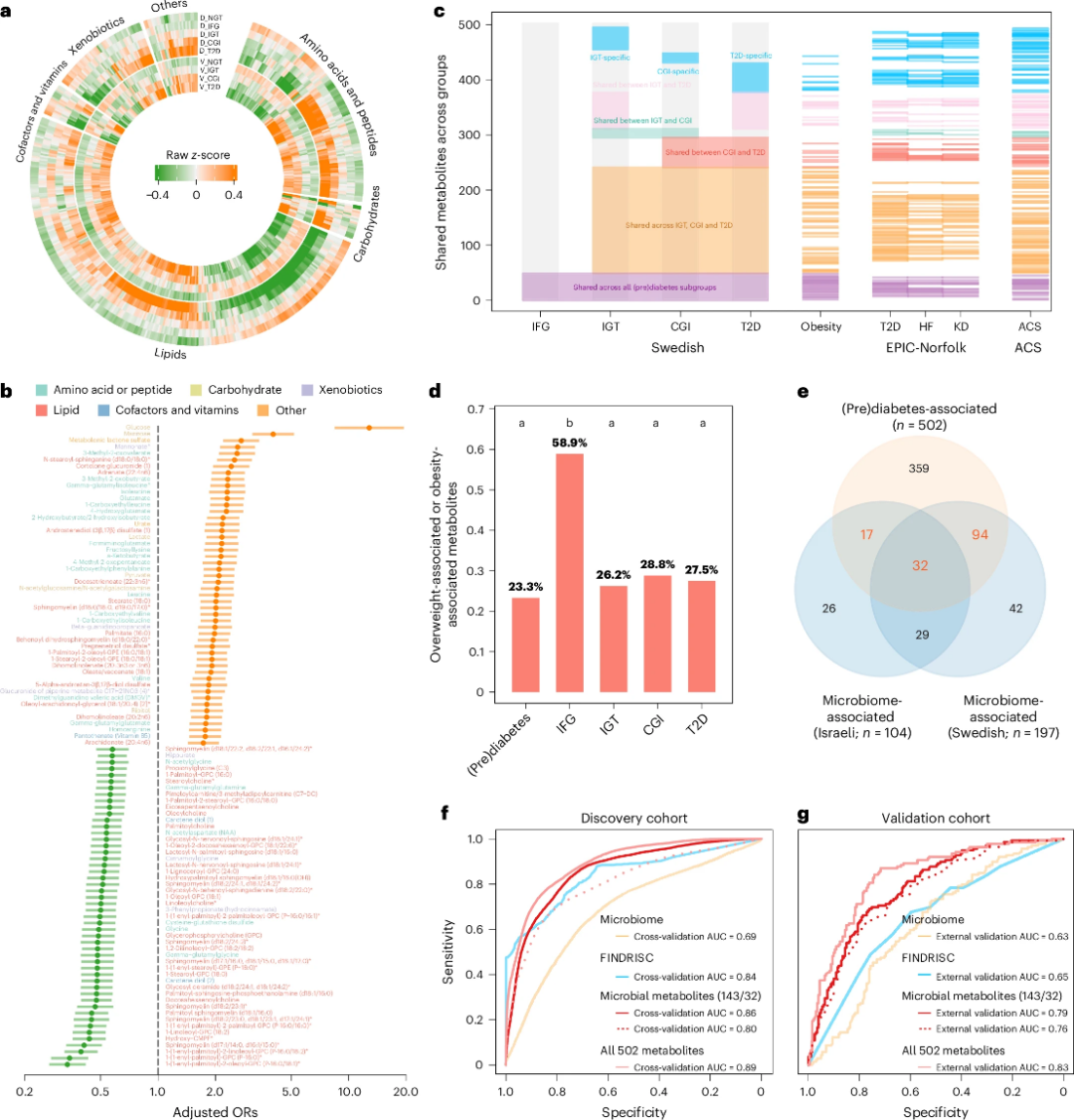
图4. 糖耐量受损及共病患者亚组的分子特征
研究团队利用SHAP特征归因方法,系统评估了肠道微生物基因组(MGS)与生活方式因素对502种糖代谢相关血浆代谢物的影响。结果显示,Hominifimenecus microfluidus、Blautia wexlerae 和Agathobacter rectalis 为调控代谢网络的关键菌种,分别通过对苯甲酸代谢产物(如儿茶酚硫酸盐、马尿酸)等的调控,构建互为抑制的代谢通路(图5a-c)。这种双向调节关系在不同人群间具有稳定性,在中瑞人群中均可验证(图5d-e)。
进一步分析发现,这些代谢物显著关联多项血糖与胰岛素指标,尤其马尿酸和儿茶酚硫酸盐对餐后2小时血糖(2h-OGTT)具有负贡献,而谷氨酸和GPC (P-16:0) 分别对胰岛素抵抗指数(HOMA-IR)呈正负相关(图5f)。此外,青春双歧杆菌与OGTT强相关代谢物(如α-酮丁酸、2-羟基丁酸)水平呈负相关,提示其潜在保护作用。
研究揭示了以H1. microfluidus为代表的关键菌种如何通过调控特定代谢物介导饮食与宿主葡萄糖稳态的互作,奠定了以代谢物为桥梁连接饮食、微生物与胰岛素敏感性的新框架,拓展了糖尿病分子分型和靶向干预的策略基础(图5)。
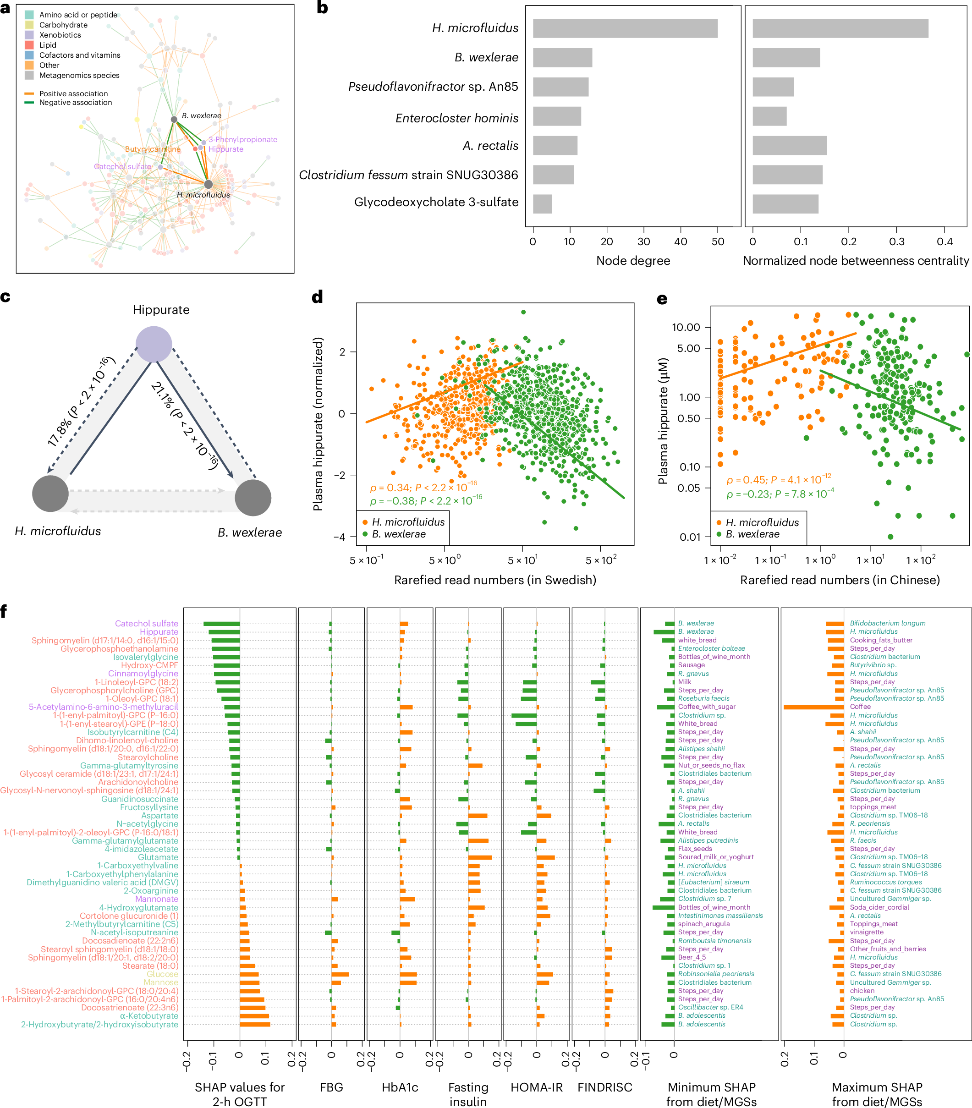
图5. 导致葡萄糖耐量异常的肠道微生物特征通过共表达分析鉴定中心SAGs
研究发现,日均步数(图5d)及多个饮食成分是影响糖尿病相关代谢物变异的关键生活方式因素。为进一步验证生活干预对糖代谢紊乱的分子响应,研究整合分析了两项纵向干预研究的数据,分别聚焦于饮食改善与运动干预。结果显示,在502种糖调控相关代谢物中,有307项可被追踪,其中125项在饮食干预后与胰岛素敏感性改善(HOMA-IR下降)相关,主要为脂质(61.6%)、氨基酸(31.2%)和外源物(7.2%)。
进一步聚类分析表明,这123种代谢物可被划分为8类,其中65.9%对至少一种干预方式有反应(图6)。其中,32种在两类干预下均可逆转,28种仅对饮食反应,21种仅对运动有效,42种则不随干预改变,提示生活方式干预对代谢物的影响具有特异性。
此外,在与葡萄糖或胰岛素指标高度相关的49个代谢特征中,有14项参与了干预响应,其中10项可被短期干预逆转,而如马尿酸、α-酮丁酸等4项未发生显著改变。进一步在中国人群中发现,马尿酸水平与高体能状态及最大摄氧量呈正相关,表明其更可能由长期运动调节。
综上,该研究揭示了饮食与运动干预可通过特异性调节肠道菌群-代谢轴中的靶向代谢物改善血糖控制,为制定个体化的2型糖尿病管理策略提供了潜在干预靶点与科学依据。
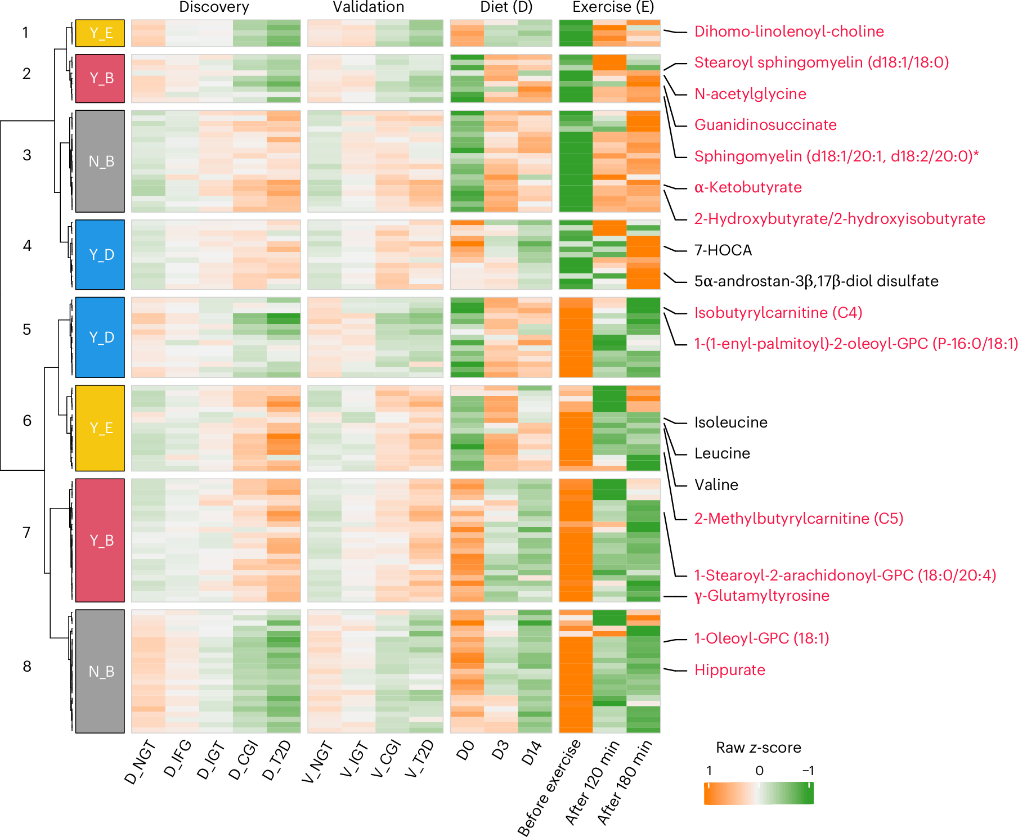
图6. 糖尿病前期和2型糖尿病相关代谢物对2周饮食干预或运动前后的响应
研究通过多组学整合分析与机器学习驱动,系统揭示了微生物组-代谢组轴在糖尿病发生发展中的核心作用,创新性地提出“菌群-代谢物-生活方式”互作框架。研究不仅鉴定出502种血糖控制相关代谢物及H. microfluidus-B. wexlerae竞争轴等关键机制,更证明饮食与运动干预对代谢通路存在差异化调节效应,为“多维度联合干预”的策略提供了分子依据。未来,结合跨种族队列研究和代谢物靶向递送技术,该方向有望推动糖尿病管理从“控糖”向“逆转”迈进,最终实现精准健康管理。
此篇文章的创新性主要是文章在不同人群队列中,包括,实验队列和验证队列中通过生信分析以及深度的机器学习,鉴定出肠道微生物相关代谢物可作为前糖尿病与T2D分子标记,并与其它疾病高度关联,同时相关代谢物也可以响应于运动和饮食干预。该文章应用前景巨大,可以将其他疾病的肠道微生物与相关的代谢物相关联,应用于其它疾病的治疗,为解决其它疾病提供新的思路。
然而文章的人群队列只将血浆中的代谢物与微生物相关联,那么相关代谢物是否能够从血液中被组织器官所摄取,进而发挥作用呢,这些是未知的。而且相关代谢物的功能均没有在文章中所验证,缺少分子实验证据。其次,研究对象主要为瑞典人群,非洲、南美等族群数据缺失,且老年人群(>65岁)代表性不足。另外文章中运动干预仅为1小时急性刺激,未能反映长期运动适应的代谢响应。
排版:野凌
审核:三黍生物企宣部


