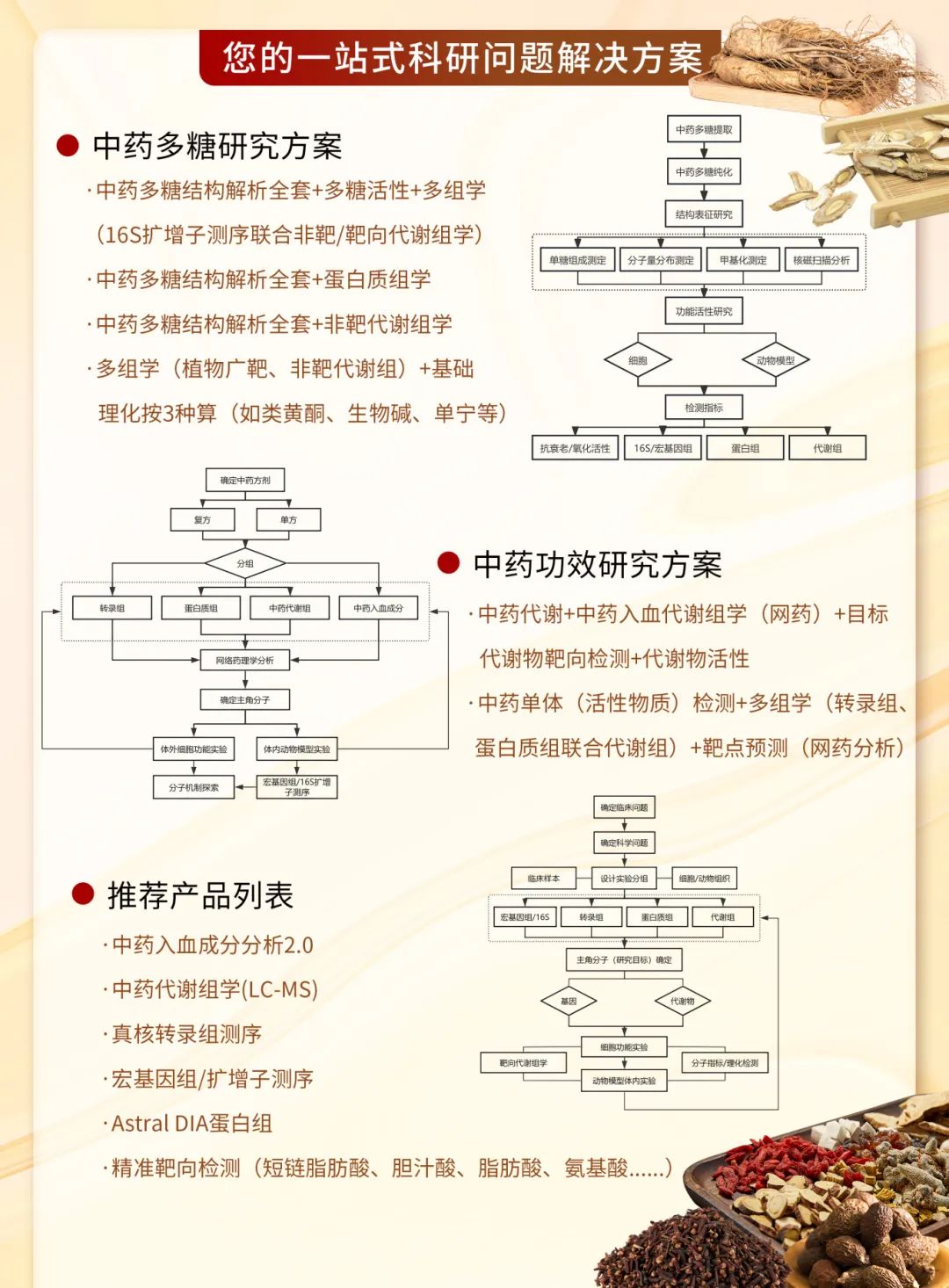
文献解读 | 传统中药方剂疗效机制系统研究,多组学整合实验设计看这篇就够了!

传统中药方剂因其复杂的多成分、多靶点特性,使得系统阐明其具体疗效作用机制存在诸多挑战。现代多组学技术为解析这些复方体系提供了新的助力。通过整合基因组学、转录组学、蛋白组学、代谢组学及微生物组学等分析手段,能够构建从宏观表型到微观分子网络的系统性研究路径。
遵循“模型建立-药物干预-多组学分析-机制验证”的设计路线,首先在合适的模型体系中模拟目标病理状态,继而引入方剂进行干预;随后运用高通量多组学技术,全面描绘药物作用对生物体在基因表达、蛋白质活性、代谢产物谱及共生微生物群落等层面的动态变化;最终通过分子生物学或功能实验对筛选出的关键通路和靶点进行验证,揭示中药方剂发挥疗效的整体调控网络与协同作用本质。
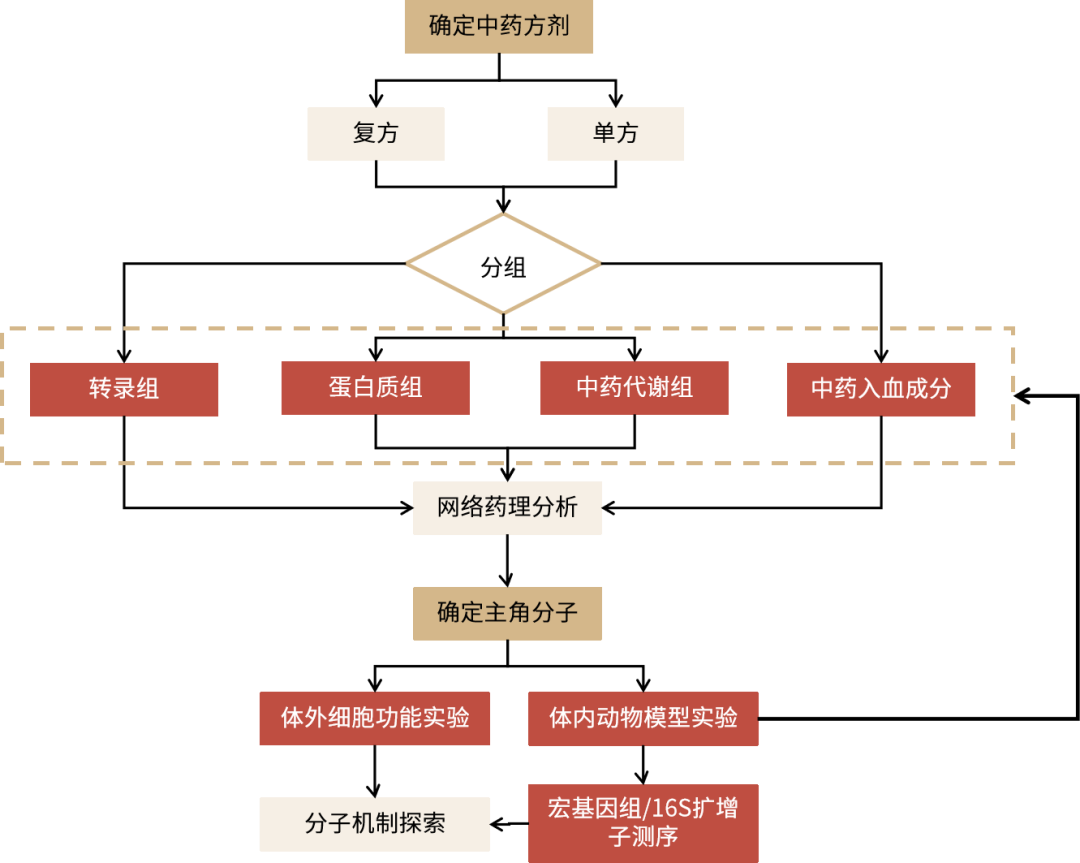
三黍中医药研究整体解决方案,更多服务详情见链接:
利用这一多组学整合策略,能够深入挖掘中药复方“多成分-多靶点-多通路”协同作用的科学内涵,为理解其治疗原理提供坚实的现代科学依据。
溃疡性结肠炎(Ulcerative Colitis, UC)是一种慢性肠道炎症性疾病,全球发病率和死亡率持续上升。
传统中药方剂白头翁汤(Pulsatilla Decoction)在治疗UC中应用历史悠久,其核心成分白头翁(Pulsatillae radix)具有清热解毒、凉血止痢的功效。近年研究发现,白头翁可通过调节肠道菌群和炎症通路缓解UC,但改良方剂(Modified Pulsatilla Decoction, MPD)的机制仍需深入探究。
2025年5月12日发表于Frontiers in Microbiology的研究(标题:Modified Pulsatilla decoction ameliorates ulcerative colitis by affecting gut microbiota and metabolite profiles)中,作者构建"模型建立-药物干预-多组学分析-机制验证"的技术路线,通过体内实验结合多组学技术探索改良白头翁汤的作用机制,揭示了这种 MPD 有可能通过减少炎症、调节肠道微生物群和肠道代谢来缓解 DSS 诱导的结肠炎。

研究对象:
动物模型:采用DSS(葡聚糖硫酸钠)诱导的UC小鼠模型,模拟人类UC的肠道炎症和黏膜损伤。
分组设计:正常对照组(无干预)、UC模型组(仅DSS诱导)和MPD治疗组(高剂量组(H 剂量)和低剂量组(L 剂量)),每组8只小鼠。
技术方法:16S rRNA测序,非靶代谢组学
动物实验设计:
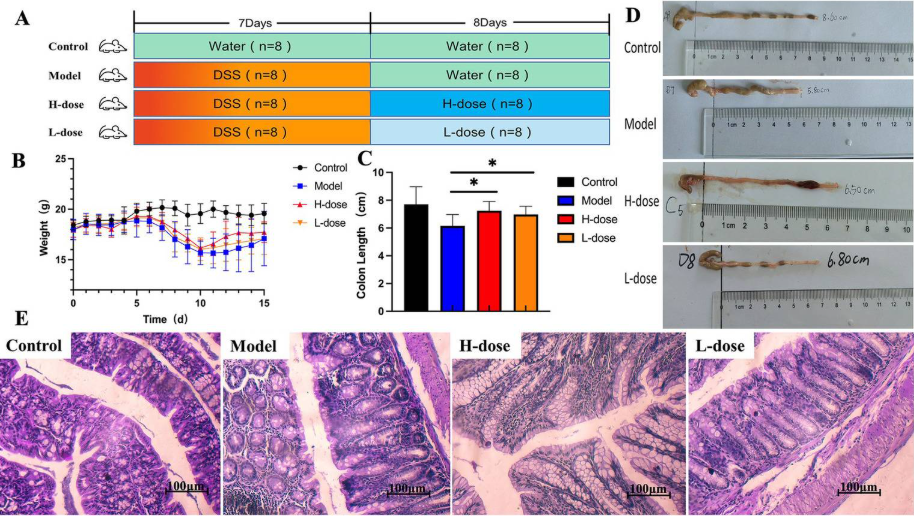
图1. MPD 可显著改善小鼠的结肠炎症状
1.MPD 的化学成分
根据 UHPLC-MS/MS 的正离子和负离子模式,将 MPD 总离子流色谱图 (TIC) 的色谱图分为两组(图 2A、B)。使用 Compound discover 3.2 软件从原始 Raw 质谱数据中提取特征峰,特征峰元素匹配、分子式预测和同位素分布匹配的质量数偏差均设置为 5 ppm 以内。使用 mzCloud 在线数据库和本地构建的中药天然产物 mzVault 数据库来识别特征峰,共鉴定出144 种化合物。峰面积最大的主要化合物包括黄芩苷、七叶苷、沃格诺苷等(图 2D)。
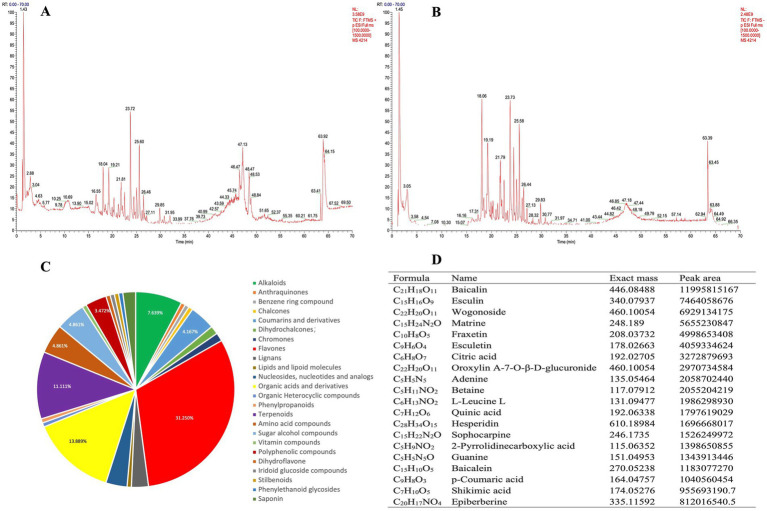
图2. UHPLC-MS/MS 对 MPD 进行化学鉴定
2.MPD对小鼠体重和结肠的影响
研究人员将32只雄性 Balb/c 小鼠 (6-7周龄,20±2 g)随机分为4组:对照组、模型组、H剂量组和L剂量组。如图1A所示,模型、H 剂量和 L 剂量组施用3%(w/v) DSS溶液7天。在接下来的8天里,通常为每组小鼠提供无菌饮用水。L剂量组小鼠以10 g/kg的剂量给予粗草药,H剂量组为20 g/kg。根据小鼠每10g体重0.1 mL的灌胃方案,对H剂量和L剂量组给予0.2 mL相应的汤剂。同时,在相同条件下,对照组和模型组给予0.2 mL无菌水。在整个实验过程中,对照组都提供无菌水。
为了评估结肠炎的严重程度,研究人员记录了所有小鼠的每日体重测量值。结果表明与对照组相比,所有DSS处理的小鼠均出现体重减轻。值得注意的是,与模型组相比,H 剂量组在高剂量MPD给药期间的体重趋于增加(图 1B)。DSS处理的小鼠也表现出较短的结肠长度,但MPD治疗显着逆转了这些变化,尤其是在较高剂量下(图 1C、D、p < 0.05)。H剂量组和L剂量组结肠组织的隐窝结构和形态均显著改善,与DSS组相比,观察到大量杯状细胞并减少炎症细胞浸润。对照组肠道切片未发现明显异常,上皮细胞层结构完整,无炎性细胞浸润。相比之下,模型组表现出广泛的炎症细胞浸润。H剂量组和 L 剂量组的上皮细胞层相对完整,炎症细胞较少。H剂量组和L剂量组之间没有显著差异(图 1E)。
3.MPD对粪便样本微生物群多样性和组成的影响
收集新鲜粪便后从中提取微生物DNA,对16S rRNA 基因的V3-V4区域进行扩增和测序。维恩图显示了三组中存在443个OTU(图 3A),主坐标分析(PCoA) 揭示了对照组和 DSS 处理组之间不同的微生物组成集群(图 3B)。这些结果表明 DSS 诱导小鼠粪便微生物群发生显著变化。另外,与对照组相比,模型组和 H 剂量组的 Chao 1 和 Sobs 指数显着降低 (p < 0.05),而 H 剂量组也表现出显着较低的 ACE 指数 (p < 0.05)。
研究人员进一步分析了门水平上最主要的微生物群,以评估各组之间肠道微生物群组成的总体变化(图3C)。与对照组和 H 剂量组相比,模型组表现出较低的放线杆菌门相对丰度 (p < 0.05)。此外,模型组和H 剂量组均显示弯曲杆菌门的相对丰度降低 (p < 0.05)。对每组中7 个主要属的分析揭示了微生物类群的特定变化(图 3D)。LEfSe 分析在对照组中确定了21个生物标志物,在模型组中确定了8个,在H剂量组中确定了4个生物标志物,表明由于DSS导致某些物种显著减少,这导致DSS组盲肠微生物群的相对丰度较低(图 4A)。葡萄球菌在门、属和类水平 (LDA >4) 在模型组中占主导地位,而H剂量组(LDA >4)的Oscillospirates更丰富(图4B)。
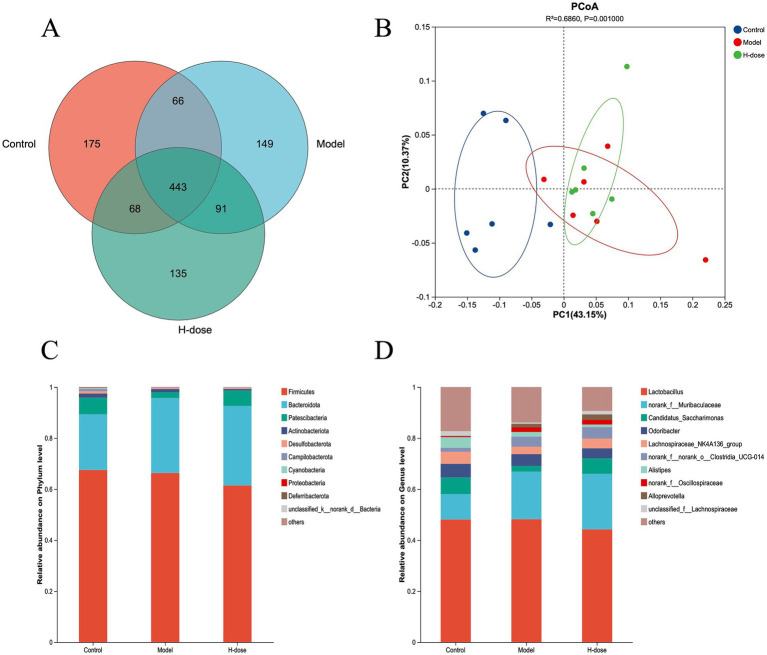
图3. 不同组小鼠肠道微生物群
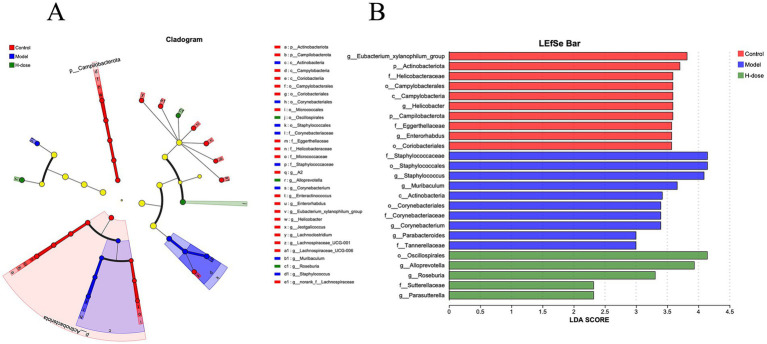
图4. 描绘三组小鼠微生物群落之间分类关联的LEfSe图
4.MPD对肠道代谢的影响
通过LC-MS检测结肠组织代谢物,筛选差异代谢物,并进行KEGG通路富集分析。正交偏最小二乘判别分析(OPLS-DA)表明对照组和模型组样品之间有明显的分离(图 5A),表明成功建立了DSS诱导的溃疡性结肠炎小鼠模型。MPD处理导致MPD和模型组样品之间明显分离(图 5B)。差异代谢物的聚类热图分析显示,MPD组的代谢物谱与对照组相似(图 5C)。这些结果表明,MPD可有效改善DSS诱导的小鼠肠道代谢紊乱。
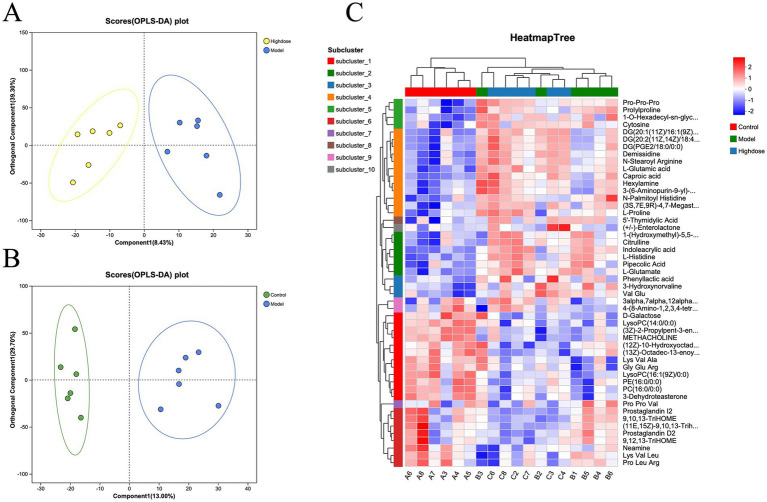
图5. 三组小鼠微生物群落之间分类关联的LEfSe图
对模型组和 MPD 组代谢物数据的进一步分析显示,与模型组相比,MPD 组有 53 种代谢物上调,22 种代谢物下调(图 6A)。为了进行更精确的分析,使用投影中的变量重要性(VIP)表示差异代谢物(图 6B)。倍数变化最大的前5位上调代谢物是(S)-7-(3-氨基-1-吡咯烷基)-1-环丙基-6-氟-1,4-二氢-4-氧代-1,8-萘啶-3-羧酸、Esculetin、戊二酸半醛、DTMP 和甘草酮。前五位下调代谢物包括依克多因、2-甲氧基雌酮、3-葡萄糖醛酸苷、苏酰精氨酸、反式培苷和 13-L-氢过木酰油酸(图 6C)。这些差异代谢物的 KEGG 富集分析表明,MPD主要影响亚油酸代谢、VEGF 信号通路、非洲锥虫病、谷氨酸能突触和 Fc ε RI 信号通路等通路(图 6D)。
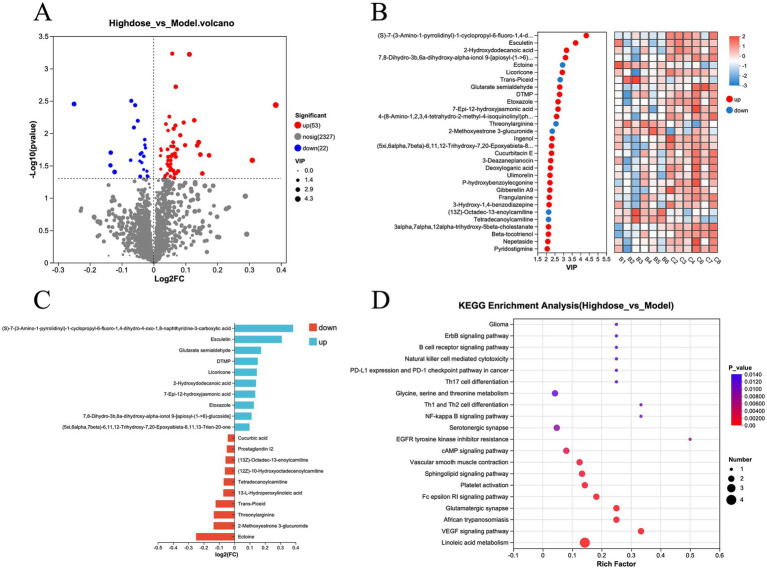
图6 差异代谢物分析图
创新点:首次阐明MPD通过菌群-代谢物-炎症通路轴缓解UC,为中药复方机制研究提供多组学整合范式。进一步研究预测的未知调控因子的功能。
临床价值:MPD可能成为替代传统免疫抑制剂的安全疗法,尤其对激素抵抗型UC患者。
局限性:未解析MPD的具体活性成分;需扩大样本量验证菌群移植的因果性。
滑动查看更多:
排版:野凌
审核:三黍生物企宣部